APPROFONDIMENTI
ASMA GRAVE E INFIAMMAZIONE DI TIPO 2
Redazione On Medicine

Nell’asma grave l’infiammazione cronica sottostante è guidata nel 50%-82% dei pazienti dalla cascata dell’infiammazione di tipo 2, promossa cioè da linfociti T-helper 2 (TH2) CD4+ e dalle cellule linfoidi innate di tipo 2 (ILC2), in cui un ruolo patogenetico fondamentale, riconosciuto dall’ultimo aggiornamento delle linee Guida GINA (GINA Pocket Guide Difficult-to-treat & severe asthma – aprile 2019), è svolto dalle interleuchine IL-4, IL-5 e IL-13.
Proponiamo a partire da questo numero una serie di approfondimenti che focalizzano i meccanismi e le conseguenze cliniche dell’infiammazione di tipo 2 nell’asma grave e trasmettono le più recenti evidenze sullo sviluppo di terapie mirate.
Parte II - L'asma grave con infiammazione di tipo 2
Fino a dieci anni fa l’asma veniva inquadrata come una malattia atopica causata da una sensibilizzazione IgE-mediata nei confronti di diversi stimoli allergenici presenti nell’ambiente esterno (pollini, muffe, acari della polvere) e dall’attivazione di una risposta immunitaria T-helper di tipo 2 (Th2).
Negli ultimi anni i pazienti asmatici sono stati tipizzati in base all’età di insorgenza del primo evento asmatico, alle manifestazioni cliniche e a fattori costituzionali e genetici, ed è emersa sempre più l’evidenza che l’asma non deve essere considerato come un’unica malattia, ma come una sindrome complessa che riconosce meccanismi eziopatogenetici di diverso tipo.
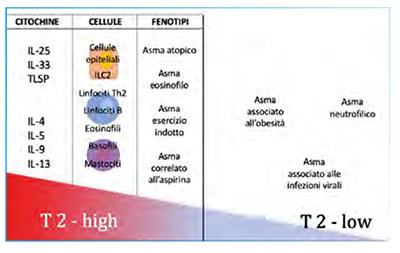
Asma, fenotipo ed endotipo
La storia della fenotipizzazione dell’asma si è articolata nel tempo sulla base dell’identificazione e tipizzazione di cluster, ovvero fenotipi, diversi. Alcuni ricercatori si sono basati sulla prevalenza dei sintomi o dell’infiammazione e sul contesto clinico nel quale il paziente veniva valutato; altri sulla base di variabili quali sesso, età di insorgenza, BMI, atopia, gravità dei sintomi, impiego di farmaci e risorse sanitarie; le linee guida GINA a loro volta hanno proposto cinque cluster facilmente identificabili:
- asma allergico
- asma non allergico
- asma late-onset
- asma con ostruzione fissa
- asma in soggetti obesi.
IL-4, IL-5 e IL-13: un ruolo definito
- IL-4 svolge un ruolo chiave nello stimolo alla differenziazione dei linfociti T in senso Th2, che induce la produzione di citochine Th2 quali, oltre alla stessa IL-4, IL-5, IL-9 e IL-13; IL-4 favorisce anche lo switch isotipico con produzione di IgE;
- IL-4 e IL-13, insieme a IL-5, determinano un aumento dei livelli ematici di eosinofili, mediando la loro migrazione nei tessuti e svolgendo un ruolo centrale nel danno tessutale caratteristico dell’asma;
- IL-4 e IL-13 sono coinvolte nel reclutamento degli eosinofili dal torrente circolatorio ai tessuti; aumentano infatti la sintesi di chemochine quali eotassina-1 e -3, che promuovono la migrazione delle cellule dal vaso al tessuto infiammato, e l'espressione delle molecole di adesione endoteliale, come la molecola di adesione delle cellule vascolari (VCAM)-1;
- nelle cellule epiteliali bronchiali, IL-13 causa una sovraregolazione della sintetasi inducibile dell'ossido nitrico (iNOS) e un aumento della produzione e secrezione di muco da parte delle cellule mucipare; influisce inoltre sulla proliferazione/contrattilità della muscolatura liscia delle vie aeree, contribuendo fortemente allo sviluppo di infiammazione e rimodellamento.
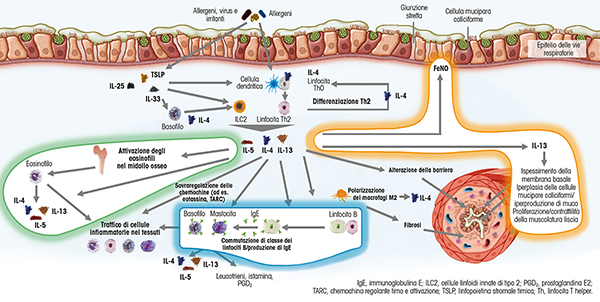
Figura 1. IL-4, IL-13 e IL-5, fattori fondamentali della fisiopatologia dell’asma (mod. da Gandhi NA et al. Nat Rev Drug Discov 2016;15:35-50; Fahy JV. Nat Rev Immunol 2015;15:57-65; Nonaka M et al. Int Arch Allergy Immunol 2010;152:327341; GINA. Diagnosis and management of difficult-to-treat and severe asthma in adolescent and adult patients. 2019).
Infiammazione di tipo 2 e biomarker
L’eosinofilia nel sangue periferico è il principale marcatore di infiammazione Th2-high e di asma difficile da trattare; pazienti con eosinofili ≥400 cell/μl hanno un rischio più elevato di riacutizzazioni e accessi ospedalieri non programmati, e possono presentare una compromissione della funzione polmonare.
La titolazione delle IgE totali e specifiche è fondamentale nell’approccio iniziale al paziente asmatico; la presenza di IgE totali elevate, indipendentemente dalla concomitanza di IgE specifiche, orienta verso una connotazione Th2-high dell’infiammazione sottostante e verso un esordio di tipo allergico della storia asmatica del paziente.
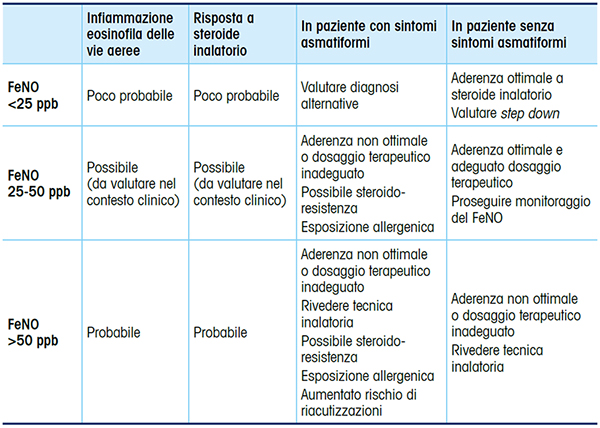
Il FeNO esprime la disreattività immunitaria dell’epitelio correlata al fenotipo infiammatorio T2-high (Fig. 2).
Utilizzato insieme ad altri test diagnostici (spirometria, broncoprovocazione, valutazione della cellularità nell’espettorato) il FeNO può rivelarsi particolarmente utile nell’individuazione di fenotipi asmatici (asma grave e non controllato) e può agevolare l’impostazione di una terapia personalizzata con farmaci biologici e il monitoraggio clinico, con conseguente aggiustamento delle dosi di ICS somministrate.
Bibliografia di riferimento
- 2016-GINA - Global Initiative for Asthma - GINA. https://ginasthma.org/2016-gina/. Accessed January 19, 2020.
- Bonser L, Erle D. Airway mucus and asthma: The Role of MUC5AC and MUC5B. J Clin Med 2017;6:112.
- Caminati M, Pham D, Bagnasco D, et al. Type 2 immunity in asthma. World Allergy Organization Journal 2018;11:13.
- Karrasch S, Linde K, Rucker G, et al. Accuracy of FENO for diagnosing asthma: A systematic review. Thorax 2017;72:109-16.
- Peters M, Wenzel S. Intersection of biology and therapeutics: type 2 targeted therapeutics for adult asthma. Lancet 2020;395:371-83.
- Rath N, Raje N, Rosenwasser L. Immunoglobulin E as a biomarker in asthma. Immunol Allergy Clin N Am 2018;38:587-97.
- Riaz N, Wolden SL, Gelblum DY, et al. Eosinophils in mucosal immune responses. Mucosal Immunol 2016;118(24):6072-8.
- Ricciardolo, FLM, Sorbello V, Ciprandi G. FeNO as biomarker for asthma phenotyping and management. Allergy Asthma Proc 2015;36(1):e1-8.
- Smith AD, Cowan JO, Filsell S, et al. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med 2004;169:473-8.
- Warner JO. Bronchial hyperresponsiveness, atopy, airway inflammation, and asthma. Pediatr Allergy Immunol 1998;9(2):56-60.
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)