NEWS
Neurologia
Amiselimod: nuova promessa nella cura della SM
Amiselimod è un modulatore selettivo orale del recettore della sfingosina 1-fosfato (S1P1) di seconda generazione che ha dimostrato di ridurre in modo dose-dipendente le misure di attività della malattia infiammatoria e le recidive cliniche per più di 24 settimane.
Un team di ricercatori coordinati da Ludwig Kappos dell’Ospedale Universitario di Basilea, ha sviluppato amiselimod per il trattamento di varie malattie autoimmunomediate e ha valutato la sua sicurezza ed efficacia in pazienti con Sclerosi Multipla Recidivante-Remittente (SMRR) in uno studio di fase II pubblicato online ad agosto 2016 su Lancet Neurology, il trial MOMENTUM.
La SM è una malattia demielinizzante infiammatoria cronica del Sistema Nervoso Centrale caratterizzata da patogenesi autoimmune, che ha dimostrato di rispondere parzialmente a una serie di trattamenti immunomodulanti. La ricerca di trattamenti più efficaci contro questa patologia è in continuo avanzamento.
I ricercatori del team del Professor Kappos hanno arruolato 415 pazienti di età compresa tra i 18 e i 60 anni con SMRR attiva afferenti a 84 Centri in Europa e Canada, randomizzati in proporzione 1:1:1:1 mediante un sistema a risposta interattiva via web a ricevere una volta al giorno per via orale amiselimod alla dose di 0,1 mg (n=105), 0,2 mg (n=103), 0,4 mg (n=104) o placebo (n=103) per 24 settimane.
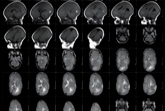
Lo studio era condotto in doppio cieco, l’endpoint primario era il numero totale di lesioni pesate in T1 captanti Gadolinio, rilevate alla Risonanza Magnetica (RM) effettuata a cadenza mensile dall’ottava alla ventiquattresima settimana di studio.
La popolazione valutabile era costituita dai pazienti che avevano completato le 24 settimane di trattamento, che non avevano avuto alcuna deviazione maggiore dal protocollo e che erano stati sottoposti ad almeno tre valide scansioni RM dopo la somministrazione della dose di farmaco.
Il numero totale medio di lesioni pesate in T1 captanti Gadolinio non è risultato differente tra il gruppo amiselimod 0,1 mg e quello in trattamento con placebo (p=0,7517) ma era significativamente più basso nei gruppi a dosaggio superiore (0,2 e 0,4 mg) rispetto a placebo (rispettivamente, p=0,0021 e p=0,0003).
Lo studio ha anche mostrato come il rapporto tra tassi di incidenza delle lesioni rispetto a placebo è diminuito in modo dose-dipendente con amiselimod (rispettivamente 0,53 con 0,1 mg; 0,39 con 0,2 mg [p=0,0001] e 0,23 con 0,4 mg [p <0,0001]), mentre l’incidenza di eventi avversi, compresi infezioni e disturbi cardiaci, è risultata in tutti i gruppi simile a quella registrata con il placebo (56% con 0,1 mg, 67% con 0,2 mg e 56% con 0,4 mg di amiselimod; 64% con placebo).
Non è stato segnalato alcun evento avverso grave durante il trattamento per più di un paziente in ogni gruppo e non è stata osservata alcuna riduzione clinicamente significativa della frequenza cardiaca a qualsiasi dose di amiselimod. Dal punto di vista del profilo di sicurezza gli eventi avversi più comuni sono stati, rispettivamente nei tre gruppi vs placebo: cefalea (10%, 10%, 10% vs 4%) e nasofaringite (9%, 7%, 10% vs 8%).
I risultati di questo trial, in termini di sicurezza ed efficacia di amiselimod in pazienti affetti da SMRR, suggeriscono che questo modulatore del recettore S1P1 rappresenti un potenziale nuovo trattamento per questa patologia e, probabilmente, per altre condizioni infiammatorie immunomediate, condizioni che giustificano la necessità di condurre ulteriori indagini su questa molecola.
Kappos L et al. Safety and efficacy of amiselimod in relapsing multiple sclerosis (MOMENTUM): a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Neurol. 2016 Aug 16. pii: S1474-4422(16)30192-2.
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)