APPROFONDIMENTI
La Broncopneumopatia cronica ostruttiva: riconoscerla subito per trattarla al meglio
Maniscalco S, Mereu C, Papi A, Pauletti A, Scichilone N

La BroncoPneumopatia Cronica Ostruttiva (BPCO) è una condizione patologica dell’apparato respiratorio caratterizzata da ostruzione al flusso aereo, cui contribuiscono alterazioni bronchiali (bronchite cronica), bronchiolari (malattia delle piccole vie aeree) e del parenchima polmonare (enfisema), indotta dall’inalazione di sostanze nocive (soprattutto il fumo di tabacco) che determinano, con vari meccanismi, un quadro d’infiammazione cronica diverso da quello dell’asma bronchiale. Clinicamente si manifesta con tosse e catarro cronici e/o dispnea, inizialmente da sforzo e successivamente anche a riposo. Può indurre importanti effetti sistemici ed essere frequentemente associata a complicanze e comorbilità, molto comuni nei soggetti più anziani e con condizione patologica più avanzata.
Cenni di epidemiologia
La BPCO rappresenta la causa più comune di insufficienza e invalidità respiratoria cronica.1 Il carattere ingravescente di tale condizione morbosa, descritto dal declino accelerato della funzione respiratoria, è responsabile del progressivo scadimento della qualità di vita dei pazienti affetti, con forti limitazioni delle attività lavorative e ricreative giornaliere e impatto sui costi socio-sanitari. Attualmente, è annoverabile tra le principali cause di morbosità e mortalità nel mondo; l’andamento della patologia risulta progressivamente crescente, tenendo conto sia della sua sottostima e sottodiagnosi, sia delle persistenti esposizioni ai fattori di rischio e dell’invecchiamento della popolazione mondiale.2 La prevalenza, la morbosità e la mortalità della BPCO variano tra i diversi Paesi e tra diversi gruppi di popolazione nell’ambito della stessa nazione: ciò è in parte imputabile alle differenze nei metodi d’indagine, nei criteri diagnostici e negli approcci analitici usati per rilevarli, tuttavia essa è più elevata nei fumatori e negli ex fumatori, nei soggetti di età superiore ai 40 anni e di sesso maschile. La prevalenza della BPCO è stata stimata intorno al 10%, con differente distribuzione in base allo staging3 e alle caratteristiche della popolazione studiata; negli studi condotti coinvolgendo diversi Paesi si è riscontrata una sottostima delle diagnosi di circa il 50%. In Italia una stima della prevalenza conferma che la BPCO colpisce una notevole porzione della popolazione (circa 4,5% della popolazione generale), con graduale aumento correlato all’età fino a raggiungere il 20% nella popolazione superiore ai 65 anni. La BPCO costituisce la quarta causa di morte in Europa e USA, ma si prevede che diventerà la terza causa nel mondo entro il 2020: questo aumento sembra dovuto all’incremento dell’abitudine tabagica, alla riduzione di mortalità per altre cause e al generale aumento dell’aspettativa di vita della popolazione mondiale, che espone per un tempo maggiore i soggetti ai fattori di rischio ambientali e voluttuari, e perché le modificazioni d’organo indotte dall’invecchiamento facilitano l’insorgenza del danno polmonare. La BPCO è inoltre la dodicesima tra le principali cause di perdita di DALY (Disability-Adjusted Life Year) nel mondo e probabilmente salirà al settimo posto entro il 2030, se non si riuscirà a intervenire sui principali fattori di rischio.4
Fattori di rischio
La BPCO è una condizione morbosa a eziologia multifattoriale e deriva dall’interazione tra fattori di tipo ambientale e fattori legati all’ospite. I fattori di rischio favorenti lo sviluppo di questa patologia sono suddivisi in fattori esogeni ed endogeni che, interagendo tra loro, determinano la caratteristica suscettibilità del soggetto a sviluppare la patologia. Tra i fattori di rischio esogeni la maggiore evidenza risiede nell’abitudine tabagica, considerata la principale responsabile dello sviluppo di malattia, seguita da inquinamento outdoor e indoor, esposizione lavorativa, fumo passivo, abuso di alcool e basso livello socio-economico.
Fattori esogeni
Fumo di tabacco
Il fumo di tabacco è attualmente responsabile, nel mondo, di 6 milioni di morti l’anno, di cui 600.000 causate dal fumo passivo; si prevede, per il 2030, un aumento a 8 milioni di morti l’anno, se non si interviene contrastando l’abitudine al fumo con maggiore efficacia. L’uso del tabacco è la singola causa di morte “evitabile” a livello mondiale ed è attualmente responsabile del 10% dei decessi per gli adulti in tutto il mondo. In Italia i fumatori sono 10,5 milioni, ossia il 20,6% della popolazione generale, con maggiore prevalenza nei maschi tra i 25 e i 64 anni. Il fumo è un importante fattore eziologico di alcune patologie respiratorie e non solo, è sicuramente considerato il maggiore responsabile dello sviluppo della BPCO e del tumore del polmone; rappresenta inoltre un elemento contrastante il controllo dell’asma. Queste patologie costituiscono la gran parte dell’onere della mortalità e morbosità delle patologie respiratorie in Europa. Lo pneumologo dovrebbe considerare il trattamento tabagico come parte integrante della terapia prescritta al paziente fumatore con BPCO o altre patologie respiratorie, deve essere in grado di assicurare, quando necessario, un intervento di secondo livello, in prima persona o ricorrendo ai centri antifumo. Il fumo di tabacco è un aerosol di sostanze nocive, alcune cancerogene, altre irritative, e, a causa della presenza di nicotina, è in grado di determinare una vera e propria dipendenza, tanto da essere considerata una condizione patologica, nella decima revisione della classificazione internazionale dell’OMS (ICD X) e nel manuale diagnostico e statistico dell’Associazione Americana di Psichiatria (DSM-IV). La carenza di nicotina porta infatti a una sindrome di astinenza caratterizzata da insonnia, craving, frustrazione, rabbia, irrequietezza, impazienza, depressione, deficit di concentrazione, difficoltà a svolgere attività quotidiane, irritabilità, aumento dell’appetito, incremento ponderale, stipsi; per questo i fumatori necessitano di aiuto, che deve essere fornito sulla base delle esigenze del singolo (individuando i principali fattori di rischio) e della gravità della malattia fumo. I fumatori presentano un rischio elevato sia per il graduale declino della funzione polmonare, in termini di FEV1 (Forced Expiratory Volume in 1 second), che può variare da 7 a 33 ml/anno, fino a un massimo di 200 ml/anno nei soggetti più suscettibili,5 con stretta correlazione dose-risposta tra declino di FEV1 e quantità di fumo, sia in relazione allo sviluppo di patologie neoplastiche. Il rischio cumulativo o assoluto, cioè la probabilità di sviluppare un tumore al polmone entro i 75 anni nei maschi, è risultato pari a 0,6% nei non fumatori, 6,5% negli ex fumatori e 13,8% nei fumatori attuali. Risultati simili si osservano nei soggetti di sesso femminile, anche se con valori assoluti di rischio inferiori. Infatti, il rischio di sviluppare un tumore al polmone è risultato pari a 0,5% nelle non fumatrici, 1,4% nelle ex fumatrici e 2,6% nelle fumatrici attuali. Il rischio aumenta all’aumentare del numero di sigarette al giorno fumate ed è maggiore quanto maggiore è l’età in cui si è smesso di fumare.6 Inoltre l’introduzione in commercio di tabacco a più basso pH, selezionato geneticamente, e di tabacco lavorato, che ne permettono una più profonda inalazione, ha determinato un cambiamento nello scenario dei tumori del polmone, sia per quanto riguarda l’istologia sia la topografia, determinando una maggior incidenza di adenocarcinomi periferici e una riduzione dei carcinomi squamosi e small-cell a sede più frequentemente centrale.7
Inquinamento
L’inquinamento outdoor o atmosferico è determinato dalla combustione di combustibili fossili, dal traffico auto-veicolare, con produzione di ossido e biossido di azoto, ossidi di zolfo e particelle fini con diametro aerodinamico inferiore a 10 µm (PM10) o a 2,5 µm (PM2,5), elementi che determinano l’innesco di una risposta locale infiammatoria che contribuisce allo sviluppo della BPCO. Possiamo considerare l’azione dell’inquinamento atmosferico suddividendola in effetti a lungo termine e a breve termine. Per i primi esiste una correlazione con l’insorgenza di malattie respiratorie sul piano sia clinico sia funzionale, con significativo decremento di FVC (Forced Vital Capacity) e FEV1.8 Per quanto riguarda invece gli effetti a breve termine si è osservato un incremento della mortalità e dei ricoveri per patologie respiratorie rispettivamente del 3,4% e dell’1%.9 La relazione tra incremento della mortalità per malattie respiratorie ed esposizione a inquinamento atmosferico è stata ulteriormente dimostrata nello studio europeo APHEA2.10 L’inquinamento indoor consiste nell’esposizione a sostanze inquinanti di ambienti confinati quali luoghi di vita e di lavoro, abitazioni, uffici, strutture comunitarie, locali destinati ad attività ricreative e sociali. L’esposizione lavorativa a polveri, fumi o gas può contribuire allo sviluppo della BPCO, con una percentuale di rischio attribuibile nella popolazione del 15% per la bronchite cronica e del 18% per le alterazioni della funzionalità polmonare compatibili con un quadro di BPCO.11 I settori lavorativi correlati al rischio di sviluppare BPCO sono l’industria metallurgica, quella estrattiva, le industrie produttrici di sostanze isolanti, plastica o vernici, le cartiere, l’industria tessile e chimica.
Fattori esogeni
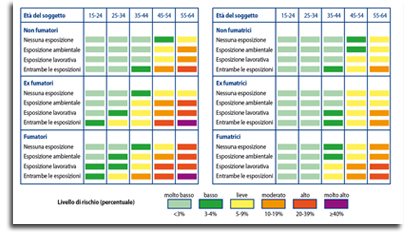
Come dimostrato da vari studi, esistono fattori di rischio diversi dall’esposizione al fumo di tabacco e all’inquinamento per lo sviluppo di BPCO: tra questi annoveriamo i fattori di rischio endogeni, che comprendono l’assetto genetico, l’età, il sesso, la crescita e lo sviluppo polmonare. Per quel che riguarda la trasmissione genetica di fattori predisponenti lo sviluppo di BPCO, è nota da tempo la relazione tra deficit di inibitore delle proteasi seriche, α1-antitripsina, e rischio di enfisema; l’invecchiamento inoltre facilita lo sviluppo della patologia, sia per il graduale declino della funzionalità respiratoria, sia per l’incremento degli anni di esposizione ad agenti patogeni, mentre il sesso non sembra influire sull’incidenza di malattia, sebbene alcuni studi suggeriscano una maggiore suscettibilità delle donne agli effetti nocivi del fumo di tabacco. La presenza di un’anamnesi positiva per infezioni respiratorie in età pediatrica si associa spesso a quadri di BPCO in età adulta, specialmente se è presente, contemporaneamente, una storia di fumo. Anche una dieta povera di sostanze antiossidanti, come frutta e verdura, e l’abuso di alcool sembrano correlati al rischio di sviluppare patologie respiratorie croniche di tipo ostruttivo. Esistono carte del rischio, relativo e assoluto, divise in base al sesso e alla specifica esposizione a fattore di rischio per malattia. Nella Figura 1 riportiamo le carte per calcolare il rischio assoluto di sviluppare BPCO a 10 anni nella popolazione maschile e femminile.6
Figura 1. Rischio assoluto di sviluppare BPCO a 10 anni dalla valutazione per la popolazione maschile (a sinistra) e femminile (a destra). Da 6.
Esistono strumenti simili per valutare anche il rischio di sviluppare tumore al polmone. Questi strumenti sono essenziali nella pratica quotidiana per capire con quale probabilità, in percentuale, il paziente potrà presentare la patologia, in modo da programmare gli interventi più adeguati per contenere o, addirittura, evitare il manifestarsi delle patologie considerate.
Fisiopatologia
Come già accennato le manifestazioni cliniche della BPCO risentono fortemente delle alterazioni strutturali del polmone associate all’invecchiamento.12 Nel parenchima polmonare si assiste ad aumento del contenuto di aria per riduzione della superficie alveolare. Il risultato dell’invecchiamento è una riduzione del rapporto superficie/volume della parte del polmone deputata agli scambi gassosi che si traduce, di fatto, in una dilatazione degli spazi aerei, senza rottura delle pareti alveolari (polmone senile); esso va distinto dall’enfisema, in cui è invece presente la rottura dei setti alveolari. La riduzione della forza di retrazione elastica che consegue a tali alterazioni strutturali contribuisce alla genesi della limitazione al flusso espiratorio e alla perdita di reversibilità dell’ostruzione bronchiale, predisponendo le vie aeree al collasso dinamico durante l’espirazione, con conseguente “pseudo-ostruzione” che può risultare indistinguibile dalla reale ostruzione. Insieme ai fattori anatomici, anche i meccanismi di difesa aspecifici delle vie aeree (tosse e clearance mucociliare) subiscono una progressiva riduzione di efficacia con l’età. L’immunosenescenza del polmone contribuisce all’aumentata suscettibilità della popolazione anziana verso processi infettivi localizzati a livello dell’apparato respiratorio. Queste considerazioni hanno indotto alla concezione della BPCO quale patologia da “accelerato invecchiamento”, con l’intento di sottolineare le convergenze tra le alterazioni indotte dai fattori causali (come il fumo) e quelle indotte dalla senescenza.
Sintomatologia e riconoscimento
Nella BPCO in fase stabile i sintomi respiratori sono sempre presenti e non esistono fasi di completa o prolungata remissione della sintomatologia. La tosse produttiva e la dispnea da sforzo costituiscono i sintomi più comuni nei pazienti affetti da BPCO: la gravità di tale sintomatologia dipende dalla prevalenza dei fenomeni di tipo ipersecretivo (tipici della bronchite cronica semplice) o di quelli propriamente ostruttivi (tipici della BPCO conclamata), oltre alle alterazioni strutturali irreversibili a carico del parenchima (enfisema). La tosse produttiva è maggiormente presente al mattino e, spesso, non sufficientemente riferita dal paziente che la considera una conseguenza ineluttabile (e pertanto accettata) dell’abitudine voluttuosa al fumo di sigaretta. La dispnea compare per sforzi fisici di entità progressivamente crescente, in funzione della progressione delle alterazioni funzionali. È noto che la limitazione dell’attività fisica nei pazienti con BPCO sia dovuta alla dispnea conseguente all’incremento del lavoro respiratorio, a sua volta secondario all’ostruzione delle vie aeree; la maggior parte dei pazienti con BPCO di grado severo presenta dispnea anche per sforzi fisici minimi, come camminare per casa, e ciò limita considerevolmente il grado di performance fisica;13 tale limitazione aumenta ulteriormente nei pazienti in ossigenoterapia. Tuttavia, evidenze scientifiche dimostrano come l’anormalità dei muscoli scheletrici costituisca una delle principali manifestazioni della BPCO.14 Ciò configura una condizione di circolo vizioso di inattività, decondizionamento fisico e dispnea, in cui l’inattività fisica può essere descritta come una conseguenza della malattia ostruttiva cronica, ma anche una causa della progressione della BPCO. Evento caratterizzante la presentazione clinica e la storia naturale della BPCO è la riacutizzazione della malattia, definita su base clinica dall’incremento dei sintomi (tosse, espettorazione, dispnea e/o viraggio dell’espettorato verso la purulenza), in genere su base infettiva, tali da motivare modifiche del regime di trattamento. Le riacutizzazioni bronchiali nel paziente con BPCO sono eventi talora drammatici, e impongono sempre un’attenta gestione perché gravate da ospedalizzazione, accelerato declino funzionale e mortalità non trascurabile.
Nell’accezione comune, l’intensità e la frequenza dei sintomi respiratori del paziente affetto da BPCO sono stabili nel tempo. Tale assunto ha limitato l’attenzione del medico sulla variabilità dei sintomi respiratori nell’arco della giornata, come avviene invece nell’asma, e che è invece riportata da quasi due terzi dei pazienti con BPCO sintomatica,15,16 rappresentando verosimilmente la principale causa di scadimento della qualità di vita. In un’indagine su scala europea recentemente condotta su 2441 pazienti affetti da BPCO grave,15 due terzi riferiva la percezione della variabilità giornaliera e settimanale dei sintomi, in particolare della dispnea; nello stesso studio emergeva la maggiore frequenza di sintomi respiratori al risveglio o nelle prime ore del mattino. Questo dato è supportato dai risultati di uno studio osservazionale,16 condotto in pazienti con BPCO, che conferma come il mattino rappresenti il peggior momento della giornata per i sintomi di questa patologia, indipendentemente dalla sua gravità; in particolare, il 37% di tutti i pazienti con BPCO e il 73% di quelli con malattia grave riferiva come invalidanti i problemi associati con le attività mattutine.
Oltre ai sintomi prettamente legati all’apparato respiratorio, i pazienti con BPCO possono presentare segni derivanti dal coinvolgimento di altri organi e apparati. La coesistenza di patologie extrapolmonari, e in particolare di deficit cognitivi, sensitivi e motori, da un lato concorre ad aggravare la condizione clinica e funzionale degli individui affetti da BPCO, dall’altro può influire sfavorevolmente sull’aderenza da parte del paziente al trattamento, determinando un aumento della morbilità, del rischio di mortalità e del ricorso alle risorse assistenziali. Una delle manifestazioni extrapolmonari più frequenti nella BPCO è la disfunzione dei muscoli scheletrici, caratterizzata da una perdita di massa muscolare, fenomeno noto come sarcopenia; a ciò può sommarsi la disfunzione della restante quota muscolare, verosimilmente secondaria ad alterazioni muscolari intrinseche (anormalità mitocondriali e perdita di proteine contrattili) o ad alterazioni dell’ambiente esterno in cui il muscolo lavora (ipossia, ipercapnia e acidosi), conseguenti alle anomalie dello scambio gassoso polmonare caratteristico della BPCO. Il regime di vita sedentario assunto frequentemente dal paziente con BPCO, e ancor di più l’allettamento, sono responsabili di una perdita netta di massa muscolare, riducendo la capacità del muscolo di generare forza e resistere alla fatica. Inoltre, nella BPCO, l’incremento di citochine proinfiammatorie può indurre un aumento del catabolismo proteico che conduce, da un lato, alla perdita di peso corporeo e, dall’altro, alla riduzione della massa muscolare. Ovviamente va ricordato il ruolo della terapia corticosteroidea prolungata per via sistemica, che può causare debolezza muscolare.
Valutazione della funzionalità respiratoria
Il carattere cronico e invalidante della BPCO è dovuto alla presenza e persistenza di ostruzione bronchiale che, pur mostrando nella pratica clinica ampi quadri di variabilità (ovvero di entità di risposta al broncodilatatore), non reverte mai totalmente. Il connotato fisiopatologico della BPCO è arricchito dalla componente di iperinsufflazione polmonare e di intrappolamento di aria (air trapping). Da un punto di vista puramente fisiopatologico, infatti, la patogenesi della dispnea va ricondotta al posizionamento del livello di respiro corrente a volumi polmonari più alti (in conseguenza dell’iperinsufflazione),17 generando una condizione svantaggiosa per la meccanica respiratoria, che esita in fatica dei muscoli respiratori e ridotta tolleranza all’esercizio fisico. La diretta conseguenza di quanto esposto è la necessità dell’esecuzione di una corretta valutazione funzionale respiratoria, affidata in prima battuta alla spirometria. La spirometria è un esame che, attraverso la misurazione dei principali volumi polmonari mobilizzabili, è in grado di fornire informazioni di notevole importanza riguardo alla funzione dell’apparato respiratorio. Tali caratteristiche, unite alla non invasività del test e al costo contenuto delle apparecchiature, fanno della spirometria uno strumento fondamentale per la valutazione delle principali patologie polmonari. L’utilità di tale esame nei soggetti anziani è probabilmente ancor più elevata che negli adulti, per vari motivi: la maggiore frequenza delle affezioni respiratorie in questa fascia di età, la ridotta percezione dei sintomi e la tendenza che i soggetti anziani hanno ad adattarsi alla ridotta funzionalità respiratoria attraverso l’adozione di uno stile di vita caratterizzato da una limitata attività fisica; inoltre, la frequente presentazione atipica e mal definibile dell’asma nei soggetti di età più avanzata e l’elevata prevalenza di condizioni di comorbilità possono interferire con il corretto iter diagnostico. Occorre ricordare che, da un punto di vista pratico, la realizzazione delle corrette manovre per la misurazione dei volumi polmonari può risultare più difficoltosa nelle fasce di età più avanzata, a causa delle modificazioni morfofunzionali cui il polmone va incontro con l’invecchiamento e dell’elevata coesistenza di più condizioni morbose: tuttavia, i risultati dello studio multicentrico italiano Sa.R.A. (Salute Respiratoria nell’Anziano)18 hanno evidenziato che un rigoroso programma per il controllo di qualità è in grado di assicurare l’ottenimento dei dati necessari, con elevata riproducibilità, nella maggior parte dei pazienti.
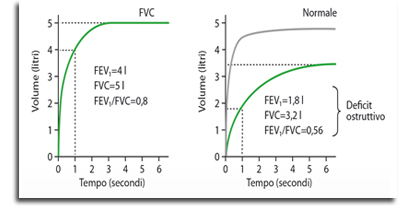
L’interpretazione del dato spirometrico va effettuata attraverso il confronto dei valori ottenuti dal soggetto in esame con quelli di riferimento (i cosiddetti valori predetti o teorici, ottenuti da soggetti sani con caratteristiche simili di età, sesso, altezza, peso ed etnia) e con quelli ottenuti dallo stesso soggetto in prove precedenti, se disponibili, al fine di verificare la stabilità o l’evoluzione delle sue condizioni respiratorie (Figura 2). Da ciò si evince che la scelta dei valori di riferimento riveste un ruolo fondamentale, poiché da essa dipendono le capacità diagnostiche della spirometria, ovvero la possibilità di dare risultati falsamente positivi o falsamente negativi.
Figura 2. Spirometria normale (a sinistra) e con sindrome ostruttiva (a destra). Da 19.
Molto spesso nella pratica clinica, al fine di semplificare la diagnosi, si fa riferimento a dei valori soglia per gli indici spirometrici, in particolare per il rapporto tra FEV1 e FVC, storicamente considerato il principale indice in grado di valutare la presenza o meno di broncoostruzione. Più precisamente, secondo le raccomandazioni GOLD (Global Initiative for Chronic Obstructive Lung Disease),19 una riduzione del flusso aereo non completamente reversibile è confermata dalla spirometria quando il rapporto FEV1/FVC post-broncodilatatore è inferiore al 70%. Tuttavia, tale criterio comporta un rischio di sovradiagnosi delle malattie ostruttive croniche del polmone nelle età più avanzate, per il declino che i volumi polmonari, soprattutto il FEV1, hanno con la senescenza. Per ovviare a ciò, si potrebbe ricorrere a valori soglia differenti nei soggetti anziani, aumentando così l’accuratezza diagnostica. Una sufficiente precisione potrebbe essere ottenuta utilizzando limiti specifici per l’età, il sesso e l’altezza del soggetto ottenuti in base al criterio dei percentili o dei valori di deviazione standard nell’ambito della distribuzione normale di soggetti sani che, se da un lato riduce la possibilità di erronea classificazione, dall’altro ne complica l’applicabilità nella pratica clinica quotidiana.
Prognosi
La storia naturale della malattia è descritta dalla disfunzione ostruttiva che connota il quadro clinico-funzionale sin dalle fasi precoci della malattia. Una valutazione accurata della storia naturale della BPCO osservata nel gruppo placebo dei più importanti studi clinici dimostra che, in realtà, il declino funzionale è più accentuato nelle fasi iniziali della malattia, ossia negli stadi di BPCO lieve o moderata; al contrario, i pazienti in stadio di malattia grave sono quelli in cui si è registrato un più lento declino della funzione respiratoria. Queste osservazioni sconfessano in parte il diagramma di Fletcher e Peto, secondo cui il declino funzionale subisce un’accelerazione nelle fasi avanzate della BPCO, incoraggiando invece programmi di identificazione e di intervento precoci nel paziente a rischio.
Trattamento
La BPCO è una patologia cronica e complessa che tende a evolvere verso stadi di maggiore gravità. Il controllo della sua progressione richiede l’eliminazione dei fattori di rischio (primo fra tutti il fumo di sigaretta) e l’esecuzione di trattamenti farmacologici e non (che includano l’ossigenoterapia a lungo termine, LTOT, la ventilazione meccanica non invasiva, NIMV, e la chirurgia, quando indicati) adeguati e protratti nel tempo, che devono essere adattati alle caratteristiche del singolo paziente. È necessario, inoltre, tenere in debita considerazione la presenza di complicanze e comorbilità, soprattutto cardiovascolari e metaboliche.
Terapia non farmacologica: la riabilitazione respiratoria
Tra le forme di intervento non farmacologico nel trattamento dei pazienti con BPCO particolare rilevanza va ascritta, in termini di efficacia clinica, alla riabilitazione respiratoria. Diversi studi controllati hanno consistentemente riportato numerosi benefici derivanti dalla riabilitazione respiratoria tra cui: miglioramento della capacità di esercizio fisico e della qualità di vita, aumentato senso di controllo da parte del paziente riguardo alla propria condizione di malattia, miglioramenti funzionali, riduzione nella durata e nel numero dei ricoveri, inferiore necessità di ricorrere a prestazioni sanitarie, e miglioramento negli indici di sopravvivenza.19
Terapia farmacologica: i broncodilatatori
Il trattamento farmacologico della BPCO riconosce un ruolo fondamentale ai broncodilatatori, che costituiscono la spina dorsale dell’intervento proposto dalle Linee Guida.19 L’introduzione di broncodilatatori a lunga durata d’azione comporta un miglioramento nell’aderenza alla terapia e in importanti outcome clinici. La prolungata azione incrementa la performance, in termini di protratta broncodilatazione post-dose, rispetto a terapie con broncodilatatori short-acting.20 I farmaci broncodilatatori a lunga durata d’azione attualmente in commercio si dividono in due categorie:
1) ß2-agonisti (LABA, come salmeterolo e formoterolo, e ultra-LABA, come indacaterolo);
2) anticolinergici (LAMA, quali aclidinio, glicopirronio e tiotropio).
1. Salmeterolo e formoterolo vanno assunti in doppia somministrazione giornaliera; formoterolo ha una più rapida insorgenza d’azione rispetto a salmeterolo. L’indacaterolo è un ß2-agonista che viene assunto in monosomministrazione giornaliera. Nuovi farmaci da poco in commercio sono olodaterolo e vilanterolo, quest’ultimo solo associato a corticosteroidi inalatori (ICS).
2. Tiotropio e glicopirronio, broncodilatatori anticolinergici, sono assunti in monosomministrazione giornaliera, mentre aclidinio bromuro viene assunto in doppia somministrazione giornaliera.21
I farmaci broncodilatatori agiscono sul tono della muscolatura liscia bronchiale, dilatando le vie aeree, mantenendone la pervietà e riducendo così la limitazione al flusso aereo. Tutte le classi farmacologiche determinano un miglioramento della funzionalità respiratoria, in termini di FEV1, con una durata d’azione differente e un inizio d’azione più o meno rapido. Salmeterolo e formoterolo, in doppia somministrazione giornaliera, migliorano il FEV1, con un effetto più rapido di formoterolo, rispetto a salmeterolo. La loro efficacia sul FEV1 è inferiore rispetto a tiotropio.22 Indacaterolo ha dimostrato, sul FEV1, una maggiore efficacia rispetto a salmeterolo e formoterolo e un effetto simile al tiotropio.23 Aclidinio bromuro è un nuovo LAMA che ha dimostrato una superiore broncodilatazione al giorno 1 di trattamento rispetto a tiotropio, con un efficace controllo dei sintomi della BPCO per tutte le 24 ore. Nel corso dello sviluppo clinico, aclidinio ha dimostrato effetti positivi su parametri spirometrici, dispnea, riacutizzazioni, qualità di vita e attività fisica.24 La molecola ha una bassa biodisponibilità sistemica e la quota circolante è sottoposta a una rapida idrolisi plasmatica in metaboliti inattivi.25 Tale aspetto favorisce un buon profilo di tollerabilità, con bassa incidenza di effetti antimuscarinici e cardiovascolari anche nel lungo periodo.26
I broncodilatatori a lunga durata d’azione sono in grado di migliorare i sintomi dei pazienti con BPCO, soprattutto la dispnea, la tolleranza all’esercizio fisico e la qualità di vita. Poiché è nota la scarsa correlazione tra FEV1 e dispnea/qualità di vita ed è stato dimostrato che il miglioramento dei sintomi a opera dei broncodilatatori si ottiene anche con modificazioni modeste del FEV1,27 il meccanismo sotteso al miglioramento di questi outcome clinici non è diretta espressione del miglioramento dei valori assoluti del FEV1: essi devono infatti essere considerati le conseguenze della riduzione delle resistenze nelle vie aeree sulla meccanica respiratoria. A seguito dell’aumentata pervietà delle vie aeree, i broncodilatatori riducono l’iperinsufflazione statica e dinamica polmonare tipica dei pazienti ostruiti con BPCO, aumentando la capacità inspiratoria e riducendo il volume residuo e la capacità funzionale residua. Queste modificazioni comportano la riduzione della dispnea e l’aumentata tolleranza all’esercizio fisico, a causa di un miglior rapporto lunghezza/tensione dei muscoli respiratori.28
L’ostruzione bronchiale nella BPCO è associata a un’infiammazione delle vie aeree. Mediante tecniche di immunoistochimica in biopsie bronchiali è stato possibile definire l’infiammazione bronchiale in fase di stabilità clinica, che è caratterizzata da un aumentato numero di macrofagi, neutrofili e linfociti T, in particolare T CD8. Tale infiammazione cronica determina lo sviluppo di danni strutturali a carico delle vie aeree (bronchiolite, enfisema) e favorisce la colonizzazione batterica. In un importante studio di valore patogenetico, Hogg e collaboratori hanno documentato, nel polmone periferico di pazienti con BPCO, un ispessimento della parete delle piccole vie aeree, con infiltrazione di cellule infiammatorie, iperplasia delle cellule muscolari lisce e fibrosi che progrediscono con la severità della malattia.29 Da questa osservazione nasce il razionale per associare i broncodilatatori ß2-agonisti a lunga durata d’azione (attualmente disponibili per le associazioni in BPCO: salmeterolo e formoterolo) con i corticosteroidi inalatori (attualmente disponibili per le associazioni in BPCO: fluticasone e budesonide) in pazienti con BPCO: le evidenze scientifiche hanno dimostrato che la somministrazione combinata delle due classi di farmaci determina, in generale, effetti maggiori rispetto a quelli ottenibili con lo stesso broncodilatatore usato in monoterapia: un miglioramento di parametri funzionali e clinici nel breve termine e una riduzione del rischio futuro di riacutizzazioni della malattia.30,31 Quest’ultimo, in particolare, è l’aspetto principale dell’indicazione delle associazioni ICS/LABA nel trattamento della BPCO. Al riguardo la combinazione fissa budesonide/ formoterolo ha dimostrato, nello studio PATHOS, di essere più efficace nella prevenzione delle riacutizzazioni rispetto a fluticasone/salmeterolo (-26,6%).32
Inquadramento e step farmacologici
Per scopi pratici e per migliorare la comunicazione, in tutti i pazienti con BPCO confermata dal rapporto FEV1/FVC inferiore al 95° percentile del valore normale teorico, può essere utile indicare i livelli di gravità dell’ostruzione:
Lieve = FEV1 >80% del valore teorico
Medio = FEV1 <80% e >50% del valore teorico
Grave = FEV1 <50% e =30% del valore teorico
Molto grave = FEV1 <30% del valore teorico
Nonostante il FEV1 sia un parametro fondamentale nella diagnosi esso, da solo, risulta inadeguato per valutare sia la complessità delle manifestazioni della malattia sia la sua progressione: esistono infatti diversi fenotipi clinici di malattia (cioè caratteristiche importanti dal punto di vista clinico che consentono di differenziare individui diversi con BPCO) che rispondono meglio di altri a specifici trattamenti.
Per avviare una terapia farmacologica efficace è necessario quindi considerare la patologia nella sua complessità, inquadrando il paziente in maniera multidimensionale, avvalendosi di strumenti aggiuntivi quali i questionari (per esempio, il Modified Medical Research Council – mMRC, o il COPD Assessment Test – CAT), per misurare la gravità della sintomatologia o lo stato di salute e la qualità di vita. È inoltre utile individuare il rischio futuro di riacutizzazioni (predetto dal numero di riacutizzazioni degli anni precedenti o dalla compromissione della funzione respiratoria – riduzione del FEV1 – che si associa a un aumentato rischio di riacutizzazioni). Per poter comprendere tutti gli aspetti clinici dei pazienti con BPCO e non solo la compromissione funzionale polmonare, sono stati proposti alcuni indici compositi come BODE,33,34 DOSE,35 ADO;36 il loro impiego clinico è, però, attualmente, limitato.37
Nonostante nessuno dei farmaci attualmente disponibili sia in grado di arrestare il declino a lungo termine della funzione polmonare e, pertanto, la farmacoterapia sia utilizzata per ridurre i sintomi, migliorare la qualità di vita, diminuire la frequenza e la gravità delle riacutizzazioni e rallentare l’evoluzione della malattia rappresentano obiettivi fondamentali da perseguire.
L’istituzione e la prosecuzione della terapia farmacologica regolare nelle persone affette da BPCO può essere sintetizzata quindi come segue.
1. Accertare la diagnosi di BPCO sulla base dell’analisi dei fattori di rischio, della sintomatologia, della dimostrazione spirometrica di ostruzione persistente al flusso aereo, del quadro clinico complessivo e di eventuali ulteriori indagini di funzionalità respiratoria.
2. Attivare provvedimenti per la cessazione dell’abitudine al fumo di tabacco.
3. Raccomandare il cambiamento degli stili di vita e in particolare:
- alimentazione equilibrata e controllo del peso;
- attività fisica;
- incoraggiamento alla socializzazione.
4. La scelta terapeutica deve essere adeguata per la singola persona e guidata dalla gravità del quadro clinico, considerato nel suo complesso di sintomi, funzione respiratoria, complicanze, comorbilità e dalle caratteristiche individuali (fenotipo) della persona che ne è affetta:38
- per i casi meno gravi saranno sufficienti broncodilatatori a rapida insorgenza e breve durata d’azione, impiegati al bisogno;19,39
- all’aumentare della gravità dei sintomi e dell’ostruzione bronchiale sarà opportuno valutare l’impiego regolare e continuativo di broncodilatatori a lunga durata d’azione (salmeterolo, formoterolo, indacaterolo, tiotropio, aclidinio, glicopirronio); a seconda dei casi è possibile decidere di associare due farmaci con diverso meccanismo d’azione (LAMA + LABA) o la combinazione LABA + ICS, in relazione anche alla frequenza delle riacutizzazioni negli anni precedenti;19,40-43
- per i casi più severi è possibile valutare l’aggiunta di un inibitore della fosfodiesterasi-4 alla terapia selezionata.19,44,45
5. Anche il follow-up è parte integrante della strategia terapeutica in questi pazienti; nelle persone in trattamento farmacologico regolare, ad ogni visita programmata si suggerisce di valutare:
- la corretta e regolare assunzione della terapia inalatoria;
- la variazione dei sintomi e, in particolare, la tolleranza all’esercizio fisico e la dispnea da sforzo;
- le modificazioni della funzione polmonare in termini non solo di FEV1 e di volumi polmonari (in base ai programmi di controlli spirometrici);
- la frequenza con la quale la persona ricorre a broncodilatatori a breve durata d’azione come supporto occasionale;
- la frequenza e gravità degli episodi di riacutizzazione;
- la frequenza e la durata degli episodi di ospedalizzazione;
- gli eventuali eventi collaterali e/o avversi.
In conclusione, la BPCO può essere annoverata tra le patologie croniche di complessa genesi con manifestazioni cliniche eterogenee e conseguente difficile gestione: ciò è testimoniato dall’enorme impatto sulla mortalità e sui costi socio-sanitari. I progressi in campo diagnostico e terapeutico aprono tuttavia nuovi orizzonti che consentono un approccio più efficace, sia per quanto riguarda il riconoscimento della patologia nella popolazione generale, sia sul miglioramento della qualità di vita e sul rallentamento del declino funzionale dei pazienti affetti da BPCO.
A cura di:
Maniscalco S
Medico Borsista S.C. Pneumologia Ospedale Pietra Ligure
Mereu C
Direttore S.C. Pneumologia ASL2 SV, Direttore Dipartimento di Specialità Mediche ASL2 SV Presidente SIMeR (Società Italiana Medicina Respiratoria)
Papi A
Professore Ordinario di Malattie dell’Apparato Respiratorio e Direttore della Clinica di Malattie dell’Apparato Respiratorio, Università di Ferrara
Pauletti A
Clinica Pneumologica, Università di Ferrara
Scichilone N
Responsabile Servizio di Allergologia e Fisiopatologia Respiratoria, UOC di Pneumologia II, Professore di Malattie dell’Apparato Respiratorio, Facoltà di Medicina e Chirurgia, Università di Palermo
Bibliografia
- Bettoncelli S, Blasi F, Brusasco V et al. Sarcoidosis Vasc Diffuse Lung Dis 2014;31:1-21.
- Walters JA, Hansen EC, Walters EH, Wood-Baker R. Respir Med 2008;102:738-43.
- Menezes AM, Perez-Padilla R, Jardim JR et al. Lancet 2005;366:1875-81.
- Mathers CD, Loncar D. PLoS Med 2006;3:e442.
- Scognamiglio A, Matteelli G, Pistelli F et al. Ann Ist Super Sanità 2003;39:467-84.
- Zuccaro P, Pichini S, Mortali C et al. Ist Sup Sanità 2004. Visto in: http:// www.goldcopd.it/materiale/iss/carta.pdf.
- Thun MJ, Carter BD, Feskanich D et al. N Engl J Med 2013;368:351-64.
- Ackermann-Liebrich U, Leuenberger P, Schwartz J et al. Am J Respir Crit Care Med 1997;155:122-9.
- Dockery DW, Pope CA 3rd. Annu Rev Public Health 1994;15:107-32.
- Katsouyanni K, Touloumi G, Samoli E. Epidemiology 2001;12:521-31.
- Viegi G, Di Pede C. Curr Opin Allergy Clin Immunol 2002;2:115-21.
- Verbeken EK, Cauberghs M, Mertens I et al. Chest 1992;101:800-9.
- Pitta F, Troosters T, Spruit MA et al. Am J Respir Crit Care Med 2005;171:972-7.
- Agusti AG, Noguera A, Sauleda J et al. Eur Respir J 2003;21:347-60.
- Kessler R, Partridge MR, Miravitlles M et al. Eur Respir J 2011;37:264-72.
- Partridge MR, Karlsson N, Small IR. Curr Med Res Opin 2009;25:2043-8.
- O’Donnell DE. Proc Am Thorac Soc 2006;3:180-4.
- Bellia V, Pistelli R, Catalano F et al. Am J Respir Crit Care Med 2000;161:1094- 100.
- The Global Initiative for Chronic Obstructive Lung Disease (GOLD). Visto in: http://www.goldcopd.com.
- Beeh KM, Beier J. Adv Ther 2010;27:150-9.
- Cazzola M, Page CP, Calzetta L et al. Pharmacol Rev 2012;64: 450-504.
- van Noord JA, Aumann JL, Janssens E et al. Eur Respir J 2005;26:214-22.
- Donohue JF, Fogarty C, Lotvall J et al. Am J Respir Crit Care Med 2010;182:155-62.
- D’Urzo A, Kerwin E, Rennard S et al. COPD 2013;10:500-10.
- Sentellas S, Ramos I, Alberti J et al. Eur J Pharmac Sci 2010;39:283-90.
- Gelb AF, Tashkin DP, Make BJ et al. Respir Med 2013;107:1957-65.
- Cooper CB. Am J Med 2006;119:21-31.
- Wedzicha JA, Decramer M, Seemungal TA. Eur Respir J 2012;40:1545-54.
- Hogg JC, Chu F, Utokaparch S et al. N Engl J Med 2004:350:2645-53.
- Calverley PM, Anderson JA, Celli B et al. N Engl J Med 2007;356:775-89.
- Kardos P, Wencker M, Glaab T et al. Am J Respir Crit Care Med 2007;175: 144-9.
- Larsson K, Janson C, Lisspers K et al. J Int Med 2013;273:584-94.
- Celli BR, Cote CG, Marin JM et al. N Engl J Med 2004;350:1005-12.
- Funk GC, Kirchheiner K, Burghuber OC, Hartl S. Respir Res 2009;10:1.
- Jones RC, Donaldson GC, Chavannes NH et al. Am J Respir Crit Care Med 2009;180:1189-95.
- Puhan MA, Garcia-Aymerich J, Frey M et al. Lancet 2009;374:704-11.
- Rossi A, Zanardi E. Respir Res 2011;12:15.
- Camiciottoli G, Bigozzi F, Paoletti M et al. Eur Respir J 2013;42:626-35.
- O’Donnel DE, Laveneziana P, Ora J et al. Thorax 2009;64:216-23.
- COMBIVENT Inhalation Aerosol Study Group. Chest 1994;105:1411-9.
- Bateman ED, Ferguson GT, Barnes N et al. Eur Respir J 2013;42:1484-94.
- Calverley PMA, Paowels R, Vestbo J for the TRISTAN study group. Lancet 2003;361:449-56.
- Vestbo J, Hurd SS, Agustì AA et al. Am J Respir Crit Care Med 2013;187:347- 65.
- Rabe KF, Bateman ED, O’Donnel D et al. Lancet 2005;366:563-71.
- Beghè B, Rabe KF, Fabbri LM. Am J Respir Crit Care Med 2013;188:271-8.
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)