IL PARERE DELLO SPECIALISTA
Scoperta di nuovi farmaci
Ongini E

Sui giornali si legge - di frequente - che sono state scoperte nuove medicine capaci di intervenire sulle patologie più diffuse. È poi vero? Oppure è la solita promozione, con l’aggiunta del giornalista che esagera per colpire nel segno i lettori?
Io ho sempre lavorato nella ricerca farmaceutica, per oltre 35 anni. Di novità ne ho viste parecchie, talvolta rivoluzionarie. Però leggo sempre con un certo scetticismo certe notizie ‘eclatanti’. Non bisogna mai dimenticare che un farmaco per essere disponibile per il trattamento ha bisogno di tempi lunghi. Circa 10 anni, se va bene. Quindi per un percorso patologico che venisse individuato oggi, se si partisse subito, il farmaco sarebbe disponibile almeno nel 2026. Un percorso lunghissimo, con numerosi ostacoli da superare. Veramente difficile.
Con questo articolo mi prefiggo di fare qualche cenno al difficile e complesso percorso di ricerca e di sviluppo del farmaco. Percorso in cui è protagonista l’industria farmaceutica.
Ricerca chimica o biotecnologica
I farmaci tradizionali sono tutti provenienti dalla sintesi chimica. Poi con la scoperta del DNA ricombinante alla fine degli anni '70 sono emersi i farmaci cosiddetti "biotecnologici", una vera rivoluzione. I farmaci biotecnologici hanno sempre occupato uno spazio maggiore e oggi per certe patologie rappresentano una parte dominante.
Come si inizia? Faccio un esempio del percorso della chimica farmaceutica, che è la strada che conosco meglio. Innanzitutto c’è bisogno di un ‘target’‘ ben preciso, sia esso un enzima, un recettore, coinvolto nella generazione della malattia che si vuole studiare. Una volta individuato il target si procede con la selezione di molecole dalla propria ‘library’ (in maniera mirata, ad esempio con procedure sofisticate quali l’High throughput screening ecc.) e si individuano le molecole che hanno un'affinità nell’ordine del basso nanomolare. Le molecole selezionate per la loro affinità devono interagire solo con il recettore o l’enzima selezionato. Quindi si valuta se ci sono inconvenienti con altri recettori o enzimi, collaterali a quello previsto. Si arriva così a poche molecole, magari con differenza di struttura. E si prosegue con lo screening su modelli di malattia per valutare se la molecola funziona, se dà inconvenienti, se ha una durata d’azione sufficiente ecc. Fino a che se arriva alla selezione di due/tre molecole che cominciano il percorso di sviluppo. Qui le regole del gioco cambiano. Si deve avere un sistema più controllato, garanzia che si possano ripetere i dati, e procedure scritte.
Il brevetto
Se non c’è possibiltà di ottenere il brevetto non si procede. Quindi appena si ottengono strutture chimiche o biotecnologiche che funzionano sul target stabilito si comincia la fase brevettuale. Il brevetto più importante è quello di prodotto, che copre tutte le strutture affini a quella identificata. In mancanza di questo e in certe condizioni si può fare un brevetto d’uso, comunque è sempre una situazione di debolezza e di dipendenza da chi ha fatto il brevetto sul prodotto.
È importante considerare che il brevetto ha una durata limitata, di 20 anni. Se si procede al deposito brevettuale subito con l’inizio della fase preclinica e ci vogliono 10 anni per arrivare al prodotto, vuol dire che si ha l’esclusiva per il farmaco solo per 10 anni. Questo è un problema. C’è qualche supplemento fino a 5 anni in certe condizioni ma comunque insufficiente (a parte c’è il percorso dei farmaci orfani, per cui vale il supplemento di 7 anni in USA e 10 anni in Europa).
Sviluppo preclinico
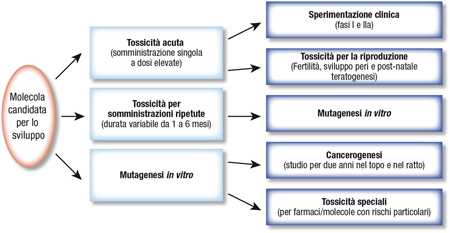
Il passaggio allo sviluppo preclinico è fondamentale. Con questo approccio si inizia il percorso essenziale, la molecole cominciano ad avere un’identità, si identificano con sigle a seconda dell’industria farmaceutica (così per esempio ‘PF’ per prodotti Pfizer, ‘Ro’ per prodotti Roche ecc). E, inevitabilmente, i ricercatori che hanno cominciato il percorso di ricerca e lo hanno terminato brillantemente finiscono il progetto passando ad altro. Una situazione agro-dolce. Qui si inizia l'iter di formulazione del prodotto, la farmacocinetica comincia a essere più consistente e le prime fasi della tossicologia e della safety cominciano a emergere. Il grafico sottostante ripercorre le fasi fondamentali di questo percorso (Figura 1)
Figura 1. Percorso degli studi tossicologici per verificare la sicurezza dei nuovi farmaci. Da notare che la molecola candidata per lo sviluppo viene esaminata nei test di tossicità acuta, di tossicità per somministrazioni ripetute e nelle prove di mutagenesi in vitro. Se non si riscontrano effetti rilevanti si può allora procedere con le fasi I e IIa dello sviluppo clinico. In parallelo si prosegue con il programma di tossicologia più completa.
Tecnica farmaceutica
In parallelo si deve mettere a punto la formulazione, sia essa per via orale o endovenosa o per altra via. È un altro aspetto critico della sperimentazione. Si può fallire perchè non si riesce a formulare un prodotto sia per la forte insolubilità o per certe caratteristiche della struttura chimica che ne impediscono la formulazione o la stabilità.
Sviluppo clinico
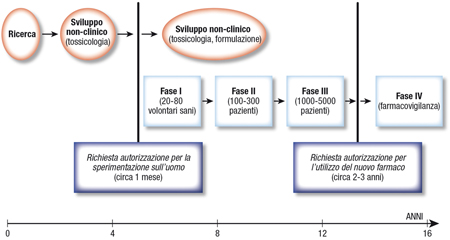
Questa è la parte più costosa del processo. Innanzitutto, prima di procedere con lo studio clinico si deve avere l’autorizzazione dagli enti deputati (per esempio, FDA, EMA) a iniziare la sperimentazione clinica. Questo è un passaggio fondamentale nel percorso di ricerca e sviluppo del farmaco. Sono mobilitati esperti, si investono soldi con l’aspettativa che la molecola cominci un cammino virtuoso. Un passaggio critico (Figura 2).
Figura 2. Percorso complessivo di ricerca e sviluppo dei nuovi farmaci. La durata del percorso di laboratorio è aumentata da 3,2 anni negli anni '60 a circa 6 anni negli anni '90. La durata delle fasi si sviluppo clinico è aumentata da 2,5 anni negli anni '60 a circa 7 anni negli anni '90. I dati si riferiscono alla situazione negli Stati Uniti.
Si inizia con la fase I (a eccezione del campo dei tumori dove in certe condizioni è previsto il passaggio immediato ai pazienti). È questa la fase del volontario sano, che si presta con il ‘consenso informato’ alla sperimentazione. In questa fase si fanno una serie di analisi, prima e dopo il trattamento, per vedere se qualche parametro è stato modificato e si procede con i test iniziali di farmacocinetica.
Se si supera la fase I si procede poi per la sperimentazione clinica sui pazienti, una popolazione selezionata sulla quale si provano dosi crescenti del farmaco in fase di studio. All’inizio la durata della sperimentazione deve essere breve. Se il potenziale farmaco risulta efficace e con pochi effetti collaterali si procede con la sperimentazione includendo più pazienti. Inizia così la fase 2, a cui fa seguito se si dimostra l’efficacia con la fase 3.
Autorizzazione all’immissione in commercio
Conclusi tutti gli studi si fa domanda di autorizzazione agli enti preposti; i quali dopo attenta analisi di tutti i dati forniti, se sono soddisfatti dai risultati ottenuti non ci sono tossicità, rilasciano l’autorizzazione al commercio del nuovo farmaco. Se si fa la somma di tutti i passaggi inevitabili del percorso si può arrivare alla registrazione in non meno di 7-8 anni, ma è difficile.
Scheda del farmaco come esempio
Faccio un esempio tratto da Nicox. Si tratta di un farmaco per il trattamento del glaucoma. Si è partiti da un’idea elaborata nel corso del 2003 e così si è arrivati a depositare un brevetto alla fine del 2004. Il contenuto del brevetto era di interesse di una società farmaceutica che ci ha contattato per discutere se si poteva lavorare insieme. Il progetto, dopo le ispezioni al sito e al brevetto, è partito alla fine del 2005. Poi, c’è stato un inconveniente perchè l'Azienda ha deciso di dismettere la linea oftalmica e ci ha restituito il progetto già in fase 2 (prove nei pazienti). In difficoltà abbiamo cominciato a ricercare un altro partner, trovando un'altra Azienda che si è dimostrata disponibile a prendersi la licenza e portare il farmaco verso l’ulteriore sviluppo. Ora il trattamento è in fase di approvazione da parte di FDA. In sintesi, il farmaco potrebbe essere approvato 12 anni dopo l‘inizio della collaborazione.
A cura di
Ennio Ongini
VP Research
Nicox
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)