APPROFONDIMENTI
ASMA GRAVE E INFIAMMAZIONE DI TIPO 2
Redazione On Medicine

Nell’asma grave l’infiammazione cronica sottostante è guidata nel 50%-82% dei pazienti dalla cascata dell’infiammazione di tipo 2, promossa cioè da linfociti T-helper 2 (TH2) CD4+ e dalle cellule linfoidi innate di tipo 2 (ILC2), in cui un ruolo patogenetico fondamentale, riconosciuto dall’ultimo aggiornamento delle linee Guida GINA (GINA Pocket Guide Difficult-to-treat & severe asthma – aprile 2019), è svolto dalle interleuchine IL-4, IL-5 e IL-13.
Proponiamo a partire da questo numero una serie di approfondimenti che focalizzano i meccanismi e le conseguenze cliniche dell’infiammazione di tipo 2 nell’asma grave e trasmettono le più recenti evidenze sullo sviluppo di terapie mirate.
Parte I - Outcome clinici dell'asma grave
L’asma è una malattia cronica delle vie aeree caratterizzata da ostruzione bronchiale più o meno accessionale, solitamente reversibile spontaneamente o in seguito alla terapia; si associa ad ampia variabilità nel tempo della funzione polmonare, di solito concordante con l’andamento dei sintomi; provoca iperreattività bronchiale e un accelerato declino della funzionalità respiratoria che può evolvere, in alcuni casi, in un’ostruzione irreversibile delle vie aeree.
Come viene definita l’asma grave?
- il documento prodotto dalla task force della European Respiratory Society (ERS) e dell’American Thoracic Society (ATS), che definisce asma grave la forma che necessita del trattamento con steroide inalatorio (ICS) ad alte dosi associato a un altro farmaco controller per prevenire che diventi non controllata, oppure che rimane non controllata nonostante questa terapia;
- il documento del Severe Asthma Research Program (SARP), che definisce asma grave il caso che presenti uno dei due criteri maggiori: alta dose di ICS oppure corticosteroide orale (OCS) per almeno il 50% dei giorni dell’anno precedente; e almeno due dei sette criteri minori: uso concomitante di un altro controller, sintomi quotidiani richiedenti il trattamento con beta-agonisti a breve durata d’azione (SABA), FEV1 <80% del predetto, necessità di almeno tre cicli di OCS durante l’anno precedente, una o più visite urgenti nell’anno precedente, deterioramento delle condizioni in caso di riduzione del 25% della dose di ICS o OCS, anamnesi di crisi asmatiche causa di rischio di vita;
- il documento della Global Initiative for Asthma (GINA), che definisce asmatici gravi i pazienti in trattamento step 4 o 5 ma solo quelli con alta dose di ICS o in trattamento con OCS.
Ruolo della funzione polmonare
Il danno strutturale sottostante alla condizione asmatica esita in una destrutturazione del parenchima polmonare e in un’alterata interdipendenza tra sistema polmonare e bronchiale; ne conseguono alterazioni fisiopatologiche di rilevanza assoluta atte a giustificare la sintomatologia che accompagna i pazienti affetti da asma grave, che possono presentare quadri di ostruzione bronchiale fissa, difficilmente o non reversibile.
Generalmente, infatti, in questi pazienti tutti gli indici di flusso espiratorio (FEV1, FEV1/FVC, FEF25-75%) sono significativamente ridotti, così come lo è la capacità vitale forzata (FVC), dato che le vie aeree si chiudono prematuramente verso la fine di un’espirazione piena. La risposta di questi indici ai farmaci broncodilatatori è di grande importanza ed è funzione della gravità dell’asma.
Durante gli attacchi asmatici i volumi polmonari sono aumentati, con una riduzione delle resistenze delle vie aeree di ogni grandezza; la terapia broncodilatatrice migliora questo quadro broncospastico.
Alcune evidenze suggeriscono che un cambiamento della tensione di superficie del rivestimento alveolare possa essere responsabile di un’alterazione delle proprietà elastiche del polmone; la perdita della retrazione elastica polmonare determina la perdita di trazione radiale sulle pareti dei bronchioli, con un loro conseguente collabimento all’atto di un’espirazione anche minimamente più rapida e forzata che di norma (ostruzione al flusso aereo da cause estrinseche). Nel caso di malattie nelle quali il lume bronchiale è diminuito di calibro, come l’asma grave, il flusso aereo risulta ridotto da un aumento delle resistenze, anche se la pressione fornita dalla forza di retrazione elastica del polmone è conservata (ostruzione al flusso aereo da cause intrinseche).
Una valutazione funzionale ventilatoria consente l’identificazione del paziente con asma grave; in modo particolare, risulta essenziale eseguire una spirometria globale che possa favorire un’approfondita valutazione dei volumi dinamici e statici (Tab. 1).

Tabella 1. Test funzionali ventilatori per la valutazione del paziente affetto da asma grave (DLCO: diffusione alveolo-capillare del monossido di carbonio; FeNO: frazione di ossido nitrico esalata)
Pazienti asmatici non controllati
Vengono definiti non controllati:
- i pazienti sintomatici (cioè che presentano frequenti sintomi diurni, che ricorrono a farmaci broncodilatatori al bisogno, che presentano limitazioni dell’attività quotidiana, che vengono svegliati di notte dall’asma);
- i pazienti con buon controllo dei sintomi, ma con due o più riacutizzazioni nell’anno precedente che abbiano richiesto l’utilizzo di OCS;
- i pazienti con buon controllo dei sintomi, ma con una o più riacutizzazioni nell’anno precedente che abbiano comportato il ricovero ospedaliero;
- i pazienti che presentano sia sintomi di non controllo sia riacutizzazioni.
Asma grave e corticosteroidi orali
L’uso cronico di OCS, tuttavia, espone i pazienti a numerosi, potenziali effetti collaterali sistemici (Tab. 2); l’avvento dei corticosteroidi per via inalatoria (ICS) e il riconoscimento che questi possono essere ugualmente efficaci nella maggior parte dei pazienti con asma hanno indotto una progressiva riduzione dell’uso di OCS, tranne che nella popolazione con asma grave che, tuttavia, nonostante il trattamento continuativo con queste molecole può continuare ad andare incontro a riacutizzazioni. Si prevede che il ruolo degli OCS diminuirà con la crescente esperienza con gli agenti biologici, che consentono una terapia più mirata.
Riacutizzazioni e qualità di vita nel paziente asmatico
Sono definite da un marcato, progressivo deterioramento dei sintomi di asma e dell’ostruzione bronchiale, che compare nello spazio di ore o giorni e può durare settimane, richiedendo spesso un cambiamento della gestione terapeutica.
Una definizione pratica di gravità della riacutizzazione asmatica, proposta dall’American Family Physician, prevede la valutazione della capacità di eloquio: l’impossibilità di esprimersi per frasi compiute a causa della dispnea è un segno di gravità di riacutizzazione che richiede il ricorso all’assistenza medica immediata.
Le comorbidità (rinosinusite, malattia da reflusso gastro-esofageo, infezioni respiratorie ricorrenti, poliposi nasale, apnee ostruttive nel sonno), così come l’effetto di allergeni e inquinanti atmosferici, possono contribuire a un aumento delle riacutizzazioni.
È noto che la percezione di malattia è influenzata da variabili fisiologiche e psicologiche. Nel descrivere l’impatto che la malattia ha sulla loro qualità di vita (QoL), i pazienti asmatici sono soliti individuare tre diversi aspetti: le riacutizzazioni, la gestione dei sintomi, la gestione della fase intercritica.
Questi aspetti si coniugano nella vita reale con la tendenza a isolarsi e ridurre le relazioni sociali. Gli asmatici sono costretti ad assentarsi spesso dal lavoro o da scuola, a interrompere le attività usualmente praticate; si innesca così un circolo vizioso che esita in un peggioramento complessivo della QoL e dello stato generale di salute.
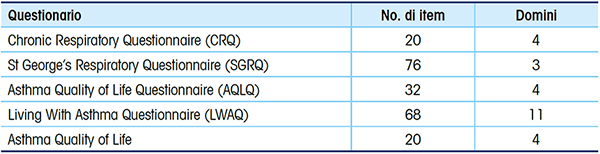
Per questo motivo, i “patient reported outcomes”, ovvero le variabili più intrinsecamente associate alla condizione clinica percepita dal paziente e all’impatto sulle attività quotidiane stanno sempre più assurgendo al ruolo di “primary outcomes” nella valutazione di efficacia dei trattamenti per l’asma; la QoL può essere valutata mediante questionari somministrati al paziente o autosomministrabili (Tab. 3).
Il ruolo delle riacutizzazioni e della QoL nel decorso e nella prognosi dei pazienti con asma grave sono quindi determinanti, e devono essere presi in considerazione nella gestione complessiva del paziente e della malattia.
Bibliografia di riferimento
- Choo XN, Pavord ID. Morbidity associated with oral corticosteroids in patients with severe asthma. Thorax 2016;71:302-4.
- Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014;43:343-73.
- Diamant Z, Boot JD, Virchow JC. Summing up 100 years of asthma. Respir Med 2007;101:378-88.
- Fahy JV. Type 2 inflammation in asthma-present in most, absent in many. Nat Rev Immunol 2015;15(1):57-65.
- Gauthier M, Ray A, Wenzel SE. Evolving concepts of asthma. Am J Respir Crit Care Med 2015;192:660-8.
- GINA Pocket Guide for Health Professionals. Difficult-to-treat & severe asthma in adolescent and adult patients. Diagnosis and management. V2.0; April 2019.
- Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention. Updated 2020. Disponibile sul sito web: www.ginasthma.org.
- Heijkenskjold Rentzhog C, Janson C, Berglund L, et al. Overall and peripheral lung function assessment by spirometry and forced oscillation technique in relation to asthma diagnosis and control. Clin Exp Allergy 2017;47(12):1546-54.
- Juniper EF, Guyatt GH, Willan A, et al. Determining a minimal important change in a disease-specific quality of life questionnaire. J Clin Epidemiol 1994;47:81-7.
- Moy ML, Israel E, Weiss ST, et al. Clinical predictors of health-related quality of life depend on asthma severity. Am J Respir Crit Care Med 2001;163(4):924-9.
- Robinson D, Humbert M, Buhl R, et al. Revisiting Type 2-high and Type 2-low airway inflammation in asthma: current knowledge and therapeutic implications. Clin Exp Allergy 2017;47(2):161-75.
- Schipper H, Clinch J, Olweny CLM. Quality of life studies: definitions and conceptual issues. In: Spilker B Editors. Quality of life and pharmacoeconomics in clinical trials. Philadelphia: Lippincott-Raven Press, 1990:11-23.
- van den Berge M, ten Hacken NH, van der Wiel E, Postma DS. Treatment of the bronchial tree from beginning to end: targeting small airway inflammation in asthma. Allergy 2013;68(1):16-26.
- Wenzel SE, Fahy JV, Irvin CG, et al. Proceeedings of the ATS workshop on refractory asthma: Current understanding, recommendations, and unanswered questions. Am J respir Crit Care Med 2000;162:2341-51.
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)