
FOCUS
Endometriosi e Nutrizione: la dieta può fare la differenza?
Occhiali T, Soave I, Marci R

A seconda di quali organi risultano coinvolti da queste “isole” di endometrio patologico, il quadro clinico può variare: dolore pelvico, dismenorrea, dispareunia ed infertilità sono fra i sintomi più comuni e, a seconda che siano coinvolti anche il tratto gastro-intestinale o le vie urinarie, possono comparire dischezia o disuria. I sintomi generalmente hanno un carattere ciclico, dettato dalla risposta del tessuto endometriale ectopico alle variazioni ormonali, ma possono anche assumere carattere cronico legato alle modifiche morfo-funzionali secondarie alla malattia (come, ad esempio, la formazione di sinechie). D’altro canto, alcune donne, seppur affette, possono essere anche completamente asintomatiche.3 Un quadro clinico così variabile rende difficoltoso stimare l’effettiva prevalenza della patologia, ma si ritiene che il 10% delle donne in età riproduttiva ed il 30-50% delle donne in generale siano colpite da endometriosi.1,2
Un altro aspetto di questa patologia che tutt’oggi rimane sfuggente è l’eziologia; esistono diverse teorie, ma nessuna di queste è in grado di spiegarne in maniera soddisfacente tutte le caratteristiche: le due più accettate sono quella della mestruazione retrograda e quella di alterata embriogenesi.
La mestruazione retrograda prevede che parte dell’endometrio in sfaldamento prenda la via delle tube fino a giungere in cavità addominale. In realtà, questo è un fenomeno fisiologico ma, nelle pazienti affette, l’endometrio patologico possiede non solo la capacità di attecchire, ma sfugge anche alla sorveglianza del sistema immunitario.4
Secondo il meccanismo dell’alterata embriogenesi, invece, durante la vita embrionale, nel corso della differenziazione dei tessuti, si verrebbero a creare isole di tessuto endometriale al di fuori dell’utero a causa di un’errata differenziazione di cellule pluripotenti.5
L’attuale terapia farmacologica si concentra prevalentemente sul controllo del dolore (FANS e oppioidi); data la natura ormonale della malattia, diverse categorie di farmaci si sono succedute negli anni: androgeni, progestinici, estro-progestinici, agonisti ed antagonisti dell’ormone di rilascio delle gonadotropine (GnRH), inibitori delle aromatasi, modulatori selettivi dell’attività del recettore degli estrogeni (SERM) e del progesterone (SPRM).6
Nel tentativo di affrontare la malattia con un approccio più quotidiano, negli ultimi anni ha suscitato grande interesse lo studio di una possibile influenza della dieta su attività infiammatoria, livelli ormonali ed altri aspetti tipici dell’endometriosi. Si tratta un argomento difficile da analizzare in maniera rigorosa, in quanto:
- non è semplice raccogliere dati precisi sulla dieta delle pazienti; spesso, infatti, si utilizzano questionari o si fa affidamento alle informazioni riportate dalle pazienti stesse che talvolta non pesano ogni loro singolo alimento
- è complicato discriminare l’effetto netto di un determinato cibo, ossia un elemento della dieta composto da svariati nutrienti, non necessariamente in proporzioni costanti fra loro o con origini diverse (basti pensare ai vegetali di origine biologica o non biologica).
Di seguito sono elencati gli alimenti su cui la letteratura si è al momento espressa, con i loro effetti biologici ed il loro eventuale legame con patogenesi e/o sintomi dell’endometriosi (Fig. 1).
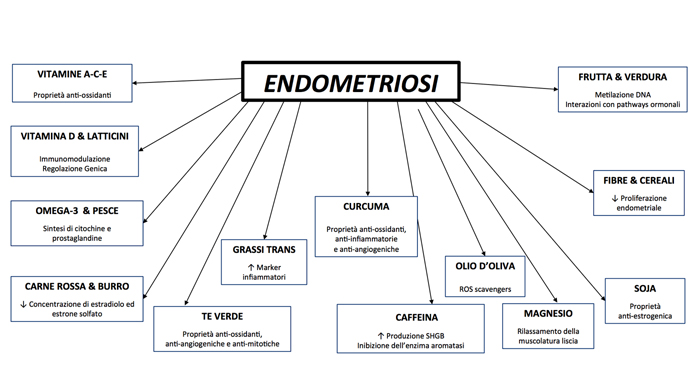
Figura 1. Processi legati all'alimentazione potenzialmente coinvolti nella patogenesi dell'endometriosi.
VITAMINE A-C-E
Essendo l’endometriosi una malattia infiammatoria, le Vitamine del gruppo A-C-E, data la loro azione anti-ossidante, potrebbero svolgere un ruolo benefico attenuando i danni prodotti da processi infiammatori locali causati da tessuto endometriosico.
Uno studio del 20097 ha riconosciuto come le donne affette da endometriosi avessero un ridotto introito di vitamine A-C-E nella loro dieta, quando paragonate a donne non affette. Nel corso dello stesso studio, a seguito di 4 mesi di dieta ricca di vitamine antiossidanti, si è notata una riduzione dei marker sierici di danno ossidativo nelle donne trattate.
Il ruolo anti-ossidante di queste vitamine sembrerebbe legato al fenomeno di perossidazione di molecole lipidiche,8 processo mediato da radicali liberi dell’ossigeno. La perossidazione lipidica potrebbe avere un ruolo centrale nella promozione della proliferazione cellulare e della neoangiogenesi, evitando pertanto la necrosi ischemica del tessuto endometriale ectopico e sostenendone il mantenimento.9
VITAMINA D
Il ruolo della Vitamina D, storicamente legato principalmente al controllo dei livelli di Calcio nell’organismo, si sta rivelando sempre più raffinato e complesso, con azioni anche in grado di interferire con processi infiammatori e proliferativi.10-13 I livelli di vitamina D potrebbero, quindi, risultare rilevanti in una malattia infiammatoria come l’endometriosi. Diverse ricerche sono state svolte a riguardo, ma i risultati ottenuti sono spesso contrastanti.
Lo studio prospettico di coorte condotto da Harris nel 201314 ha messo in evidenza come le donne che consumavano latticini almeno 3 volte al giorno avessero una probabilità inferiore di ricevere diagnosi di endometriosi. D’altra parte, in uno studio successivo, i livelli di Vitamina D sono risultati più elevati nelle donne affette da endometriosi.15 Questa ambiguità potrebbe essere spiegata dal fatto che le cellule del sistema immunitario posseggono normalmente gli enzimi per la produzione di Vitamina D in forma attiva. Sembrerebbe pertanto plausibile ipotizzare che i livelli più elevati riscontrati nelle pazienti affette da endometriosi possano essere il risultato di un’anomala produzione locale da parte delle cellule che compongono il milieu infiammatorio della malattia. Diventa perciò molto complesso correlare in modo affidabile i livelli sistemici di vitamina D con dieta e stadio della malattia.16
MAGNESIO
Il magnesio, minerale contenuto prevalentemente in vegetali, latte, banane e noci, possiede una nota azione miorilassante nei confronti della muscolatura liscia. Nel contesto dell’endometriosi esplicherebbe la sua funzione riducendo il tono della muscolatura liscia delle tube uterine, contenendo, in ultimo, il fenomeno della mestruazione retrograda.17,18
Lo studio di Harris et al.14 ha effettivamente riscontrato una correlazione inversa tra apporto di magnesio e diagnosi di endometriosi: dai dati analizzati, l’effetto benefico di questo minerale si noterebbe solo quando il magnesio è assunto con la dieta ma non quando proviene da integratori alimentari.
FRUTTA E VERDURA
Quale influenza abbiano frutta e verdura rimane oggetto di discussione. La verdura, in particolare quella in foglia, contiene agenti lipotropi (come metionina, vitamina B6, folati) che sono coinvolti nei meccanismi di controllo dell’espressione genica e della metilazione del DNA.19,20 Infatti, un deficit di questi nutrienti porta ad una ridotta metilazione delle sequenze CpG del genoma, che potrebbe favorire l’insorgenza della malattia.21,22 Inoltre, frutta e verdura possono contenere organo-clorurati (derivanti dall’utilizzo di pesticidi), molecole capaci di interferire con l’attività di androgeni e di estrogeni, sovvertendo i normali equilibri ormonali dell’organismo.23 Il grado di contaminazione di frutta e verdura potrebbe, quindi, giustificare i risultati discordanti ottenuti fino ad oggi: Parazzini e coll.24 hanno riconosciuto un ruolo protettivo nel consumo di verdura, mentre Trabert25 ha individuato nella frutta un possibile fattore di rischio, non riconoscendo alcuna associazione con il consumo di verdura. Merita un inciso la soia, che, grazie al suo contenuto di fito-estrogeni,26 sembrerebbe in grado di svolgere una funzione protettiva nei confronti delle forme più avanzate di endometriosi (stadi III e IV).27
GRASSI
I grassi saturi, le cui fonti principali sono carne rossa e burro, possono indurre un modesto incremento dei livelli di estradiolo e di estrone solfato. Essendo l’endometriosi una malattia estrogeno-dipendente, ci si aspetterebbe pertanto un franco legame tra queste sostanze ed il rischio di sviluppare la malattia (o un aggravarsi dei sintomi). Sperimentalmente, però, si trovano Autori che riconoscono nocivo solo il burro ma non la carne,24 solo la carne ma non il burro,28 o nessuno dei due,25 rendendo difficile esprimere un giudizio netto.
I grassi mono-insaturi, che si assumono con olio d’oliva (ed altri olii di origine vegetale), carne rossa e latticini, sono in grado di moderare i danni prodotti dai radicali liberi dell’ossigeno,29 ma non sembra abbiano un legame effettivo con l’endometriosi.30
Gli acidi grassi trans sono rari in natura, ma comuni nei cibi processati (margarina, cioccolato, biscotti). Tali molecole sembrerebbero essere in grado di interferire con il metabolismo degli acidi grassi essenziali, in particolare alterando sintesi e metabolismo degli acidi grassi poli-insaturi.31 In effetti, pazienti con diete ricche in grassi trans hanno marker infiammatori, quali Proteina C Reattiva o interleuchina 6, elevati e sembrano molto più propense a sviluppare la malattia.30,32
Gli acidi grassi polinsaturi, contenuti prevalentemente in noci, pesce, alghe e semi33, sono molecole molto citate nella letteratura scientifica. I più comuni nella dieta umana sono gli omega-6 e gli omega-3 e, nell’organismo umano, il rimaneggiamento di queste molecole porta alla produzione di diversi mediatori infiammatori. Dagli omega-6 derivano molecole con maggiore potenziale pro-infiammatorio come l’Acido Arachidonico, mentre dagli omega-3 deriva l’Acido Eicosapentaenoico, caratterizzato da un’azione prevalentemente anti-infiammatoria. Ne consegue che a seconda di quali acidi polinsaturi (omega-6 o omega-3) prevalgano nella dieta, si assisterà ad una maggior tendenza pro- o anti-infiammatoria. A riguardo esistono raccomandazioni, che non trovano però il consenso di tutti, di mantenere un apporto di omega-6 e omega-3 in rapporto di 4:1 o 2:1 (contro il 50:1 o 10:1 che più tipicamente caratterizza una dieta povera in verdura e pesce).33,34 Il principale mediatore infiammatorio derivante dall’Acido Arachidonico è la prostaglandina PgE₂ che non solo promuove la produzione di citochine ed enzimi attivi contro la matrice cellulare, ma anche l’attivazione di macrofagi e la sintesi di estrogeni35-37. Dal momento che gli estrogeni stessi promuovono la sintesi di molecole pro-infiammatorie (e di prostaglandine), si rischia di favorire un ciclo capace, almeno in parte, di auto-alimentarsi. Considerando, invece, l’Acido Eicosapentaenoico, studi in vitro hanno messo in evidenza come cellule endometriosiche esposte ad un mezzo di coltura con elevata concentrazione di grassi omega-3 abbiano una minor capacità di sopravvivenza rispetto a quelle private di Acido Eicosapentaenoico38. In aggiunta, studi condotti su modelli animali affetti da endometriosi e nutriti con una dieta ricca in omega-3 hanno mostrato come numero e dimensioni delle lesioni fossero significativamente ridotti rispetto al gruppo di controllo. Parallelamente all’involuzione delle lesioni, è stata anche riscontrata una riduzione delle concentrazioni dei marker infiammatori nel liquido peritoneale degli animali studiati.39-41 I promettenti dati dei modelli animali non sembrano però trovare una corrispondente correlazione negli esseri umani: secondo lo studio di Missmer et al.30 le donne con una dieta ricca in grassi omega 3 avrebbero un rischio minore di ricevere diagnosi di endometriosi, in particolare se anche l’apporto di grassi trans risulti ridotto. D’altra parte, diversi altri Autori, riconoscono sì un rischio ridotto, dato che però non è supportato da una significatività statistica.25,28
FIBRE E CEREALI
Fibre e cereali rappresentano la principale fonte di nutrienti in diversi paesi, tipicamente quelli meno sviluppati socio-economicamente, mentre sono meno abbondanti in altre diete, come quella occidentale. Le fibre, che non essendo assorbite a livello intestinale aumentano la massa fecale e, quindi, la velocità di transito nel tratto gastro-enterico, sono in grado di interrompere il ricircolo entero-epatico degli estrogeni andando perciò a ridurre il pool di ormoni disponibili.42 I cereali, invece, rallentano lo svuotamento gastrico, da cui consegue una riduzione del picco insulinico. L’insulina, a livello endometriale, agisce tramite due meccanismi principali, uno diretto ed uno indiretto. Da un lato, le cellule endometriali, sia eutopiche che ectopiche, esprimono recettori per l’insulina che, quando attivati, stimolano la proliferazione cellulare;43 dall’altro, l’insulina riduce di livelli della globulina che si lega agli ormoni sessuali (SHBG) aumentando di conseguenza la quota di ormoni sessuali biologicamente disponibile.44,45 Una dieta ricca in cerali è, quindi, in grado di contenere il picco insulinico e pertanto di limitare l’azione pro-mitotica dell’insulina stessa a livello di tessuto endometriale.
CURCUMA
La curcuma è una spezia che deriva dalla pianta erbacea Curcuma Longa, e per le sue diverse proprietà è stata usata fin dall’antichità per trattare affezioni ginecologiche.46 In particolare, ha un’azione antiossidante, anti-infiammatoria, anti-angiogenica e anti-metastatizzante.47-50 Studi in vitro su cellule epiteliali e stromali di lesioni endometriosiche umane hanno dimostrato come la curcuma sia in grado di ridurre la proliferazione delle cellule stromali in maniera dose-dipendente.51 La curcuma esplica il suo ruolo anti-infiammatorio modulando in senso negativo l’espressione di diverse citochine (IL-6, IL-8, monocyte chemoattractant protein-1- MCP-1), riducendo l’attivazione e la traslocazione dal fattore nucleare κB (NF-κB) e limitando la produzione di molecole di adesione nelle cellule stromali ectopiche.5253,54 In un recente studio,55 90 pazienti affette da endometriosi (stadio IV) sono state sottoposte per 3 mesi ad una dieta che prevedeva una marcata riduzione nel consumo di latticini, carne, caffè, alcool, soja, glutine, margarina, grassi saturi e aloe. Sono stati poi ulteriormente identificati 3 sottogruppi da 30 componenti ciascuno: il gruppo 1 durante i 3 mesi di dieta ha ricevuto un’integrazione di quercitina, curcuma, partenio, nicotinamide, sale di metil-tetraidrofolato di calcio, omega 3 e omega 6, il gruppo 2 solo di olio di semi di lino, mentre il gruppo 3 solo un placebo (gruppo di controllo). In 21^ giornata del ciclo mestruale, prima e dopo la dieta, sono stati valutati diversi fattori quali sintomatologia (tramite scala visuo-analogica), livelli di 17 beta-estradiolo (17-βE2), PgE2 e di antigene carboidratico 125 (CA125). Nelle misurazioni effettuate dopo i 3 mesi di dieta, il gruppo 1 ha mostrato una riduzione dei sintomi e dei marker infiammatori, dove gli altri due gruppi non hanno riportato alcun miglioramento.
CAFFÉ
Tra le sostanze più diffuse e consumate a livello mondiale, si annovera sicuramente il caffè. Uno degli effetti riconosciuti di questa molecola è la sua capacità di aumentare la produzione epatica di SHBG,56,57 Il legame di questa globulina con il testosterone, fa sì che questo ormone risulti meno disponibile per essere convertito in estrogeni (conversione operata dall’enzima aromatasi)58 e di conseguenza, data la ridotta biodisponibilità, ci si potrebbe aspettare una riduzione della sintomatologia legata all’endometriosi o ad altre malattie ormono-dipendenti più in generale. In studi retrospettivi, però, solo due Autori hanno riportato una correlazione statisticamente significativa tra consumo di caffè ed endometriosi.59,60
TE VERDE
Il tè verde rappresenta un’altra bevanda molto diffusa a livello mondiale. In particolare, sono state studiate le proprietà di un polifenolo abbondante in questo tipo di te, l’Epigallocatechina Gallato (EGCG). Questa molecola, date le sue capacità antiossidanti e antimitotiche, è già stata oggetto di studio come possibile terapia in diversi tipi di malignità.61,62 Partendo dal presupposto che l’endometriosi condivide alcuni step con il processo di carcinogenesi (proliferazione, invasione ed alterazione dei pathway apoptotici), alcuni Autori hanno ipotizzato un possibile ruolo di EGCG nella patogenesi della malattia. In modelli in vitro, l’utilizzo di EGCG si è mostrato capace di ridurre sia la proliferazione cellulare estrogeno-indotta nelle lesioni endometriosiche, sia l’espressione di vascular endothelial growth factor (VEGF), vascular endothelial growth factor-C (VEGFC) e del recettore tipo 2 di VEGF (VEGFR2).63,64 Quando EGCG è stato utilizzato in modelli animali, si è registrata una riduzione delle dimensioni e del peso delle lesioni endometriosiche, un ridotto tasso di proliferazione ed una minore densità microvascolare, andando, perciò, a confermare ciò che si era rilevato in precedenza in modelli in vitro.65,66 Un ultimo effetto di EGCG è quello di limitare i processi fibrotici, fenomeni tipici delle malattie infiammatorie.67
CONCLUSIONI
Allo stato attuale risulterebbe improprio prendere una posizione netta nei confronti dei nutrienti e/o cibi sopraelencati. Innanzitutto perché i ricercatori, tranne quando lavorano su modelli animali o colture cellulari, devono fare affidamento su informazioni riportate dalle pazienti stesse che, inoltre, non sono sempre raggruppate in gruppi omogenei (a volte sono donne già in menopausa, a volta in età riproduttiva, a volte sane a volte affette). In più, gli alimenti sono formati da moltissimi componenti: riferirsi, ad esempio, al consumo di “latticini” implica compiere una grossolana approssimazione, così come riferirsi alla “frutta”. Un alimento può perfettamente contenere molecole potenzialmente dannose e potenzialmente benefiche al tempo stesso. Si sta formando, in ogni caso, un pool di dati sempre crescente, e si stanno ottenendo sempre più informazioni sulle vie molecolari influenzate dai nutrienti studiati, andando ad arricchire le conoscenze di metabolomica in nostro possesso, presupposto fondamentale per poter dare indicazioni precise alle pazienti affette.
GLOSSARIO
Dismenorrea Dolore associato al ciclo mestruale
Dispareunia Dolore durante l'atto sessuale
Dischezia Stitichezza conseguente a incapacità a effettuare l'atto della defecazione
Disuria Difficoltà e dolore nell'emissione di urina
A cura di:
a cura di Tommaso Occhiali1, Ilaria Soave2, Roberto Marci3
1School of Medicine, University of Ferrara, Italy
2Department of Medical and Surgical Sciences and Translational Medicine, Sant’Andrea Hospital, Faculty of Medicine and Psychology, University of Rome “Sapienza”, Rome, Italy
3Department of Morphology, Surgery and Experimental Medicine, Section of Gynecology and Obstetrics, University of Ferrara, Italy
Bibliografia
- Dunselman GAJ et al. ESHRE guideline: management of women with endometriosis. Human Reproduction 2014;29:400–12
- Houston DE et al. The epidemiology of pelvic endometriosis. Clin Obstet Gynecol 1988;31:787–800
- Nnoaham KE et al. World Endometriosis Research Foundation Global Study of Women’s Health Consortium, impact of endometriosis on quality of life and work productivity: a multicenter study across ten countries. Fertil Steril 2011;96:366–73
- Vigano`P et al. Principles of phenomics in endometriosis. Hum. Reprod. Update 2012;18:248–59
- Laganà AS et al. Interplay between misplaced Müllerian-derived stem cells and peritoneal immune dysregulation in the pathogenesis of endometriosis,” Obstetrics and Gynecology International 2013
- Lindsay SF et al. Emerging therapy for endometriosis. Expert Opin Emerg Drugs. 2015;20:449-61
- Mier-Cabrera J et al. Women with endometriosis improved their peripheral antioxidant markers after the application of a high antioxidant diet. Reprod Biol Endocrinol. 2009;7:54
- Traber MG et al. Vitamins C and E: beneficial effects from a mechanistic perspective. Free Radic Biol Med. 2011;51:1000-13
- McCubrey JA et al. Reactive oxygen species-induced activation of the MAP kinase signaling pathways. Antioxid Redox Signal. 2006;8:1775-89
- Lasco A et al. Improvement of primary dysmenorrhea caused by a single oral dose of vitamin D: results of a randomized, double-blind, placebo-controlled study. Archives of internal medicine 2012;172:366-7
- Correale J et al. Immunomodulatory effects of Vitamin D in multiple sclerosis. Brain 2009;132:1146-60
- Hewison M. Vitamin D and the immune system: new perspectives on an old theme. Rheum Dis Clin North Am. 2012;38:125-39
- Chambers ES et al. The impact of vitamin D on regulatory T cells. Curr Allergy Asthma Rep. 2011;11:29-36
- Harris HR et al. Dairy-food, calcium, magnesium, and vitamin D intake and endometriosis: a prospective cohort study. Am J Epidemiol. 2013;177:420-30
- Somigliana E et al. Vitamin D reserve is higher in women with endometriosis. Hum Reprod. 2007;22:2273-8
- Baeke F et al. Vitamin D3 and the immune system: maintaining the balance in health and disease. Nutr Res Rev. 2007;20:106-18
- Altura BT et al. Endothelium-dependent relaxation in coronary arteries requires magnesium ions. Br J Pharmacol. 1987;91:449–51
- D’Angelo EK et al. Magnesium relaxes arterial smooth muscle by decreasing intracellular Ca2+ without changing intracellular Mg2+. J Clin Invest. 1992;89:1988–94
- McCabe DC et al. DNA methylation, genomic silencing, and links to nutrition and cancer. Nutr Rev. 2005;63:183-95
- Riscuta G et al. Nutrigenomics: implications for breast and colon cancer prevention. Methods Mol Biol. 2012;863:343-58
- Pogribny IP et al.Molecular alterations in hepatocarcinogenesis induced by dietary methyl deficiency. Mol Nutr Food Res. 2012;56:116-25
- Guo SW. Epigenetics of endometriosis. Mol Hum Reprod. 2009;15:587-607
- Grassi G et al. Polychlorobiphenyls (PCBs), polychlorinated dibenzo-p-dioxins (PCDDs) and dibenzofurans (PCDFs) in fruit and vegetables from an industrial area in northern Italy. Chemosphere 2010;79:292–8
- Parazzini F et al. Selected food intake and risk of endometriosis. Hum Reprod. 2004;19:1755-9
- Trabert B et al. Diet and risk of endometriosis in a population-based case-control study. Br J Nutr. 2011;105:459-67
- Kuiperet G al. Interaction of Estrogenic Chemicals and Phytoestrogens with Estrogen Receptor β.Endocrinology. 1998:139:4252–63
- Tsuchiya M et al. Effect of soy isoflavones on endometriosis: interaction with estrogen receptor 2 gene polymorphism. Epidemiology 2007;18:402–8
- Heilier J et al. Environmental and host-associated risk factors in endometriosis and deep endometriotic nodules: a matched case–control study. Environmental research 2007;103:121-9
- Psaltopoulou T. et al. Olive oil intake is inversely related to cancer prevalence. a systematic review and a meta-analysis of 13,800 patients and 23,340 controls in 19 observational studies. Lipids Health Dis.2011;10:127–37
- Missmer SA et al. A prospective study of dietary fat consumption and endometriosis risk. Human Reproduction 2010, deq044
- Kummerow FA et al. Trans fatty acids in hydrogenated fat inhibited the synthesis of the polyunsaturated fatty acids in the phospholipid of arterial cells. Life Sci. 2004;74:2707–23.
- Mozzaffarian D. Trans fatty acids – effects on systemic inflammation and endothelial function. Atheroscler. Suppl. 2006;7:29–32
- Simopoulos AP: The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomed Pharmacother 2002; 56:365–79
- Khanaki K et al. Evaluation of the relationship between endometriosis and omega-3 and omega-6 polyunsaturated fatty acids. Iranian Biomedical Journal 2012;16:1
- Bulun SE: Endometriosis. N Engl J Med 2009;360:268–79
- Wu MH et al. Prostaglandin E2: the master of endometriosis? Exp Biol Med (Maywood) 2010;235:668–77
- Wu MH et al. Distinct regulation of cyclooxygenase-2 by interleukin-1beta in normal and endometriotic stromal cells. J Clin Endocrinol Metab 2005; 90:286–95
- Gazvani M et al. High ω-3: ω-6 fatty acid ratios in culture medium reduce endometrial-cell survival in combined endometrial gland and stromal cell cultures from women with and without endometriosis. Fertility and sterility 2001;76:717-22
- Netsu S et al. Oral eicosapentaenoic acid supplementation as possible therapy for endometriosis. Fertil Steril 2008;90:1496–502
- Covens AL et al. The effect of dietary supplementation with fish oil fatty acids on surgically induced endometriosis in the rabbit. Fertil Steril 1988;49:698–703
- Herington J et al. Dietary fish oil supplementation inhibits formation of endometriosis-associated adhesions in a chimeric mouse model. Fertil Steril 2013;99:543–50
- Kaneda N et al. Fat and fiber intakes in relation to serum estrogen concentration in premenopausal Japanese women. Nutr. Cancer 1997;27:279–83
- Nagamani M et al. Specific binding and growth-promoting activity of insulin in endometrial cancer cells in culture. Am J Obstet Gynecol 1998;179:6–12
- Kazer RR. Insulin resistance, insulin-like growth factor I and breast cancer: a hypothesis. Int J Cancer 1995;62:403–6
- Nestler JE, Powers LP, Matt DW, Steingold KA, Plymate SR, Rittmaster RS, et al. A direct effect of hyperinsulinemia on serum sex hormone-binding globulin levels in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab 1991;72:83–9
- Gupta SC et al. Multitargeting by turmeric, the golden spice: from kitchen to clinic. Mol. Nutr. Food Res. 2013;57:1510–28
- Maheshwari RK et al. Multiple biological activities of curcumin: a short review. Life Sci. 2006;78:2081–7
- Prasad S et al. Recent developments in delivery, bioavailability, absorption and metabolism of curcumin: the golden pigment from golden spice. Cancer Res. Treat. 2014;46:2-18
- Shanmugam MK et al. The multifaceted role of curcumin in cancer prevention and treatment. Molecules. 2015;20:2728–69.
- Arablou T et al. Curcumin and endometriosis: Review on potential roles and molecular mechanisms. Biomed Pharmacother. 2017;97:91-7.
- Zhang Y et al. Curcumin inhibits endometriosis endometrial cells by reducing estradiol production. Iran. J. Reprod. Med. 2013;11:415-22.
- Kim KH et al. Curcumin attenuates TNF-a-induced expression of intercellular adhesion molecule-1, vascular cell adhesion molecule-1 and proinflammatory cytokines in human endometriotic stromal cells. Phytother. Res. 2012;26:1037–47
- Jana SK et al. Letrozole and curcumin loaded-PLGA nanoparticles: a therapeutic strategy for endometriosis. J. Nanomed. Biother. Discov. 2014;4
- Jana S et al. Curcumin as anti-endometriotic agent: implication of MMP-3 and intrinsic apoptotic pathway. Biochem. Pharmacol. 2012;83:797–804
- Signorile PG et al. Novel dietary supplement association reduces symptoms in endometriosis patients. J. Cell. Physiol. 2017; doi: 10.1002/jcp.26401.
- Gerhard I et al. The limits of hormone substitution in pollutant exposure and fertility disorders. Zentralbl. Gynakol 1992;114:593–602
- Ferrini RL et al. Caffeine intake and endogenous sex steroid levels in postmenopausal women. The Rancho Bernardo Study. Am J Epidemiol. 1996;144:642-4
- Wedick NM et al. The effects of caffeinated and decaffeinated coffee on sex hormone-binding globulin and endogenous sex hormone levels: a randomized controlled trial. Nutr J. 2012;11:86
- Grodstein F et al. Relation of female infertility to consumption of caffeinated beverages. Am J Epidemiol. 1993;137:1353-60
- Matalliotakis IM et al. Epidemiological characteristics in women with and without endometriosis in the Yale series. Arch Gynecol Obstet. 2008;277:389-93
- Beltz LA, et al. Mechanisms of cancer prevention by green and black tea polyphenols. Anticancer Agents Med Chem 2006;6:389-406
- Khan N et al. Multitargeted therapy of cancer by green tea polyphenols. Cancer Lett 2008;269:269–80
- Laschke MWet al. Epigallocatechin-3-gallate inhibits estrogen-induced activation of endometrial cells in vitro and causes regression of endometriotic lesions in vivo. Hum Reprod. 2008;23:2308-18
- Xu H et al. Anti-angiogenic effects of green tea catechin on an experimental endometriosis mouse model. Hum Reprod. 2009;24:608-18
- Wang CC et al. Prodrug of green tea epigallocatechin-3-gallate (Pro-EGCG) as a potent anti-angiogenesis agent for endometriosis in mice. Angiogenesis 2013;16:59-69
- Ricci AG et al. Natural therapies assessment for the treatment of endometriosis. Hum Reprod. 2013;28:178-88
- Matsuzaki S et al. Antifibrotic properties of epigallocatechin-3-gallate in endometriosis. Hum Reprod. 2014;29:1677-87
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)




