IL PARERE DELLO SPECIALISTA
Micosi cutanee: appropriatezza terapeutica e antimicotico-resistenza
Collino M

Appropriatezza terapeutica nelle micosi
I criteri per considerare adeguato il trattamento delle dermatomicosi sono diversi. Un trattamento si può definire appropriato se il suo impiego è supportato da una diagnosi confermata da analisi di laboratorio; se il farmaco somministrato ha indicazione specifica per quella condizione e/o viene raccomandato da uno specialista esperto; oppure se il trattamento è ben tollerato, se viene prescritto secondo protocolli terapeutici validati e se ha un rapporto costo-beneficio favorevole.1
Ciclopirox e la resistenza dei miceti
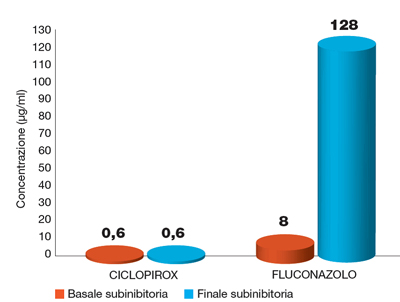
I miceti sono organismi che hanno sviluppato strategie di sopravvivenza in ambienti ostili a seguito dell’impiego in agricoltura di fungicidi e del sempre più diffuso ricorso ad antifungini per la profilassi o la terapia di condizioni morbose, anche a livello topico.2 Ciclopirox è un fungicida impiegato da 30 anni, per il quale non sussistono segnalazioni di resistenza da molto tempo. Uno studio clinico ha messo in evidenza come un’esposizione a ciclopirox della durata di 6 mesi (vale a dire per circa 80 generazioni) di ceppi di Candida albicans è risultata costantemente attiva, mentre la sensibilità a fluconazolo è diminuita di 16 volte (Figura 1).3
Figura 1. Resistenza di Candida albicans dopo esposizione a ciclopirox o fluconazolo (Elaboraz. grafica dati testuali)3
Fungicida multi-target:
Il meccanismo d’azione di ciclopirox prevede che questa molecola agisca simultaneamente sul nucleo, sul citoplasma e sui rivestimenti cellulari delle cellule del micete,3-5 modulando l’espressione di geni coinvolti nel metabolismo del ferro e interferendo con i processi mitotici e di condensazione della cromatina.3-5
L’effetto del fungicida consiste nel rallentare il metabolismo cellulare, bloccare l’attività di mitocondri, ribosomi, microsomi ed enzimi intracellulari3-5 e distruggere la parete e la membrana cellulare.3-5
La chelazione del ferro media l’azione a cascata e comporta la morte delle cellule micotiche in quanto il ferro è un componente centrale delle vie implicate nella vitalità, nella crescita e nella replicazione delle cellule micotiche.3-5 Ciclopirox è l’unico antifungino in grado di chelare questo elemento. Questa azione inibisce progressivamente, a cascata, sempre più enzimi ferro-dipendenti,3-5 bloccando la crescita e l’accessibilità all’ossigeno delle cellule del micete, provocandone infine la morte.3-5
L’azione chelante di ciclopirox porta inoltre a una riduzione della produzione di radicali liberi dell’ossigeno, effetto che, associato alla capacità di inibire la cascata dell’acido arachidonico, conferisce al farmaco anche un blando effetto antinfiammatorio.6,7 La concentrazione di ciclopirox nella cellula fungina può arrivare a essere fino a 200 volte superiore rispetto all’ambiente esterno, inoltre questa molecola non è metabolizzabile e la sua azione è irreversibile.5 L’elevata capacità di penetrazione transungueale della molecola consente di raggiungere concentrazioni elevate di farmaco tali da indurre la negativizzazione irreversibile delle colture micetiche in quasi il 100% dei pazienti.3
Trattamento delle dermatomicosi della cute e annessi
Ciclopirox e i derivati azolici sono considerati tra i farmaci di prima scelta nel trattamento topico delle candidiasi. In particolare, questa molecola risulta efficace in questa condizione anche in caso di resistenza agli azolici, ha un profilo rischio/beneficio migliore degli antifungini per os e una tollerabilità dimostrata.3
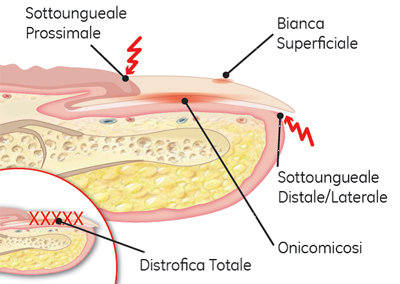
Nel trattamento topico delle onicomicosi la formulazione in veicolo volatile agisce attraverso evaporazione dello stesso, comportando la formazione di un film concentrato sulla superficie della lamina ungueale capace di fungere da deposito del principio attivo, in modo da facilitarne la diffusione (Figura 2).8
Nell’onicomicosi ciclopirox smalto, associato ad avulsione chimica, ha dimostrato un rapporto costo/beneficio migliore rispetto ad amorolfina soluzione ungueale.9
Figura 2. Quadro clinico di tinea unguium
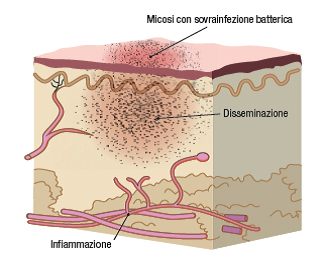
In alcuni casi, in corso di dermatomicosi può verificarsi una sovrainfezione a livello cutaneo (Figura 3).
Figura 3. Sovrainfezione batterica in corso di dermatomicosi
Questa condizione è provocata da una disseminazione batterica che ha come conseguenza un’infiammazione del tessuto. In presenza di flogosi intensa e/o di sovrainfezione batterica l’impiego di ciclopirox è preferibile per le sue proprietà antinfiammatorie e per lo spettro d'azione che lo caratterizza, esteso anche ai batteri Gram positivi e ad alcuni comuni Gram negativi.8,10
Conclusioni
Le conseguenze di un trattamento inadeguato delle micosi possono comportare non solo il completo insuccesso terapeutico, ma anche snaturare la morfologia delle lesioni, esporre a eventuali sovrainfezioni, prolungare i tempi di guarigione e sovraccaricare di costi inutili il Sistema Sanitario Nazionale e i pazienti stessi.1 Secondo un recente studio clinico, la percentuale totale dei costi evitabili correlati a trattamenti inadeguati è risultata pari all’84%.1 I casi più frequenti di inappropriatezza prescrittiva riguardano l’uso non adeguato di antimicotici (per tipo di molecola, dosaggio, forma farmaceutica e durata della terapia) e di antibiotici, antistaminici e corticosteroidi. Ma anche la mancanza di una conferma diagnostica della condizione patologica da trattare può comportare una prescrizione non appropriata.1
A cura di:
Collino M
Dipartimento di Scienza e Tecnologia del Farmaco, Università degli Studi di Torino
Bibliografia
1) Fiammenghi E et al. Cost analysis of inappropriate treatments for suspected dermatomycoses. Farmacoeconomia. Health economics and therapeutic pathways 2015;16(2):39-44.
2) Pfaller MA. Antifungal drug resistance: Mechanisms, epidemiology, and consequences for treatment. Am J Med 2012;125(1 Suppl):S3-13.
3) Subissi A et al. Ciclopirox: recent nonclinical and clinical data relevant to its use as a topical antimycotic agent. Drugs 2010;70(16):2133-52.
4) Almeida B et al. An atypical active cell death process underlies the fungicidal activity of ciclopirox olamine against the yeast Saccharomyces cerevisiae. FEMS Yeast Res 2007;7(3):404-12.
5) Niewerth M et al. Ciclopiroxolamine treatment affects the expression pattern of Candida albicans genes encoding virulence factors, iron metabolism proteins, and drug resistance factors. Antimicrob Agents Chemother 2003;47(6):1805-17.
6) Nakashima T et al. Inhibitory or scavenging action of ketoconazole and ciclopiroxolamine against reactive oxygen species released by primed inflammatory cells. Br J Dermatol 2007;156(4):720-7.
7) Sato E et al. Ciclopirox olamine directly scavenges hydroxyl radical. Int J Dermatol 2008;47(1):15-8.
8) Papini M et al. Micosi superficiali. Linee guida e raccomandazioni SIDeMaST 2014. Ed Pacini.
9) Paul C et al. A multicenter, randomized, open-label, controlled study comparing the efficacy, safety and cost-effectiveness of a sequential therapy with RV4104Aointment, ciclopiroxolamine cream and ciclopirox film-forming solution with amorolfine nail lacquer alone in dermatophytic onychomycosis. Dermatology 2013;227(2):157-64.
10) Gupta AK, Plott T. Ciclopirox: a broad-spectrum antifungal with antibacterial and anti-inflammatory properties. Int J Dermatol 2004;43 Suppl 1:3-8.
-
Farmacologia clinica dei farmaci anticoagulanti
Marco Moia Centro Emofilia e Trombosi - Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico di Milano
-
Sintomi del basso apparato urinario dopo chirurgia pelvica: fisiopatologia e trattamento
Enrico Finazzi Agrò - Professore Associato; Cattedra di Urologia, Università di Roma “Tor Vergata”; UOSD Servizio di Urologia Funzionale, Policlinico Tor Vergata; IRCCS Ospedale S. Lucia, Roma
-
Fisiologia di apprendimento e memoria
Mariano Pedetti - SerT MVT, AUSL2 dell‘Umbria, Marsciano (PG)