F. Magonio
Nel 2017 è stato assegnato il Premio Nobel per la medicina a tre ricercatori statunitensi, J. Hall, M. Rosbash e M. Young, per aver scoperto i meccanismi molecolari che regolano i ritmi circadiani. Nell’uomo, il più potente sincronizzatore dei ritmi circadiani è la luce. Al mattino la luce ambientale è dominata dalle alte frequenze cromatiche (colori freddi, luce blu) che, insieme al calo della melatonina e al picco di cortisolo, inducono il risveglio. Alla sera invece vi è la predominanza delle basse frequenze cromatiche (colori caldi, luce rossa) che, insieme alla riduzione del cortisolo circolante e all’aumento della melatonina, conciliano il sonno. Il nostro organismo sarebbe quindi sincronizzato con i ritmi della luce naturale, ossia con l’alternanza del giorno e della notte. In realtà, questo sincronismo è stato perfetto fino a quando l’uomo è vissuto nelle caverne ma con l’introduzione della luce artificiale, all’interno e all’esterno dei luoghi dove viviamo, siamo oggi sottoposti a una costante ed eccessiva esposizione luminosa anche quando è notte!
La luce ambientale interagisce con i nostri occhi per il 30% attraverso i “fotorecettori visivi” (coni e bastoncelli) che, grazie al meccanismo della fototrasduzione, sono responsabili della visione degli oggetti, dei dettagli, dei colori, del campo visivo, della stereopsi, del contrasto ecc. Il 70% della luce ambientale, e soprattutto quella blu a 460 nm, viene invece captata dai cosiddetti “fotorecettori non visivi” (cellule ganglionari intrinsecamente fotosensibili). Queste cellule, che rappresentano solo il 3% di tutte le ganglionari, hanno un’alta soglia di stimolazione (occorre quindi molta luce per stimolarle) e sono collegate, attraverso il tratto retino-ipotalamico, ai nuclei soprachiasmatici e all’epifisi che rappresentano i centri di regolazione dei ritmi circadiani. Un aumento dell’intensità luminosa avrà come principale conseguenza la ridotta secrezione di melatonina e l’inibizione del sonno. Quindi la maggior parte della luce ambientale non ha la funzione di permetterci di vedere, bensì di regolare i ritmi circadiani. In questi ultimi anni si è molto parlato del ruolo che la luce blu avrebbe nella patogenesi della degenerazione maculare senile (DMS). Con la diffusione e l’eccessivo utilizzo di PC, smartphone, TV e lampadine a LED che emettono luce blu, i nostri occhi sarebbero sottoposti a un danno fotossidativo diretto che a livello maculare potrebbe dare origine al processo degenerativo. Questi studi sono però stati condotti su cellule in vitro, prive quindi di tutti quei sistemi di protezione di cui dispongono i nostri occhi (cornea, diaframma irideo, cristallino, corpo vitreo, epitelio pigmentato, circolazione coroideale ecc.) e quindi rispecchierebbero poco la condizione reale.
Degenerazione maculare
Tuttavia, quando parliamo di degenerazione maculare dovrebbe sorgere spontanea una domanda. Perché solo la parte centrale della retina, ossia la macula, va incontro al processo degenerativo caratterizzato dalla formazione di drusen, distrofia e atrofia dell’epitelio pigmentato (DMS secca) e di neovascolarizzazioni sottoretiniche, emorragie, essudazione (DMS umida)? Si potrebbe rispondere facilmente che, essendo la macula l’area di retina metabolicamente più attiva, e quindi producendo molte scorie, sarebbe quella più a rischio di degenerare. In realtà la DMS, che rappresenta la prima causa di ipovisione e cecità legale nei paesi industrializzati, è una patologia complessa, a eziopatogenesi multifattoriale nella quale intervengono meccanismi epigenetici, fotossidativi, neuroinfiammatori, eccitotossici, vascolari. Non dimentichiamoci, però, che esiste un fattore fondamentale, un induttore, senza il quale questi meccanismi non avrebbero origine e quindi la degenerazione maculare non si potrebbe manifestare. Questo fattore è rappresentato dalla luce! Infatti, senza luce i nostri fotorecettori maculari non attiverebbero la fototrasduzione e quindi non avrebbero la possibilità di innescare quella cascata di eventi che, in particolari condizioni, potrebbe dare origine al processo degenerativo.
Struttura dei fotorecettori
I fotorecettori consistono di un segmento esterno, che è la porzione ricca di molecole sensibili alla luce (rodopsina nei bastoncelli, iodopsina nei coni), di un piccolo segmento intermedio chiamato “ciglio” e di un segmento interno che contiene il nucleo, gli organelli citoplasmatici, le vescicole di neurotrasmettitore e il bottone sinaptico. I fotorecettori hanno una caratteristica unica tra le cellule eccitabili: quando vengono stimolati dalla luce, non generano potenziali d’azione ma si iperpolarizzano (ossia riducono il loro potenziale di membrana da -40 mV a -70 mV) e trasmettono il segnale luminoso dal segmento esterno a quello interno come impulso elettrotonico, modulato, sottosoglia che lungo il proprio tragitto si riduce di intensità. La presenza del ciglio tra il segmento esterno (dove ha origine l’impulso elettrico) e il segmento interno (che riceve l’impulso) permetterebbe al fotorecettore di “filtrare” gli alti flussi di corrente (in base alla I e II legge di Ohm) che altrimenti potrebbero, in presenza di luce, depolarizzare inappropriatamente il segmento interno, compromettendo la fototrasduzione e la trasmissione sinaptica. In pratica, il ciglio avrebbe la stessa funzione di un fusibile in un circuito elettrico. Inoltre, i fotorecettori quanto più sono illuminati, e quindi iperpolarizzati, tanto meno neurotrasmettitore (glutammato) rilasciano nello spazio extracellulare. Viceversa, in condizioni di buio il fotorecettore si depolarizza (da -70 mV a -40 mV) e rilascia una quantità maggiore di glutammato.
Qual è l’area di retina che, in condizioni fisiologiche, riceve più luce?
La cornea fa convergere i raggi luminosi verso la pupilla e, grazie all’accomodazione del cristallino e alla contrazione del diaframma irideo, la luce sarà convogliata soprattutto sulla regione maculare ove i fotorecettori saranno iperpolarizzati. È evidente che questo fenomeno si verificherà ogniqualvolta utilizzeremo la vista per vicino e, ancor più, davanti a una sorgente luminosa. Questa condizione di persistente iperpolarizzazione dei fotorecettori maculari (soprattutto coni) potrebbe creare le condizioni elettrochimiche affinché una qualsiasi molecola (farmaco, ormone, gas) possa inappropriatamente depolarizzare i fotorecettori alla luce, alterare il meccanismo della fototrasduzione e aumentare il rilascio di glutammato nello spazio extracellulare (Fig. 1).
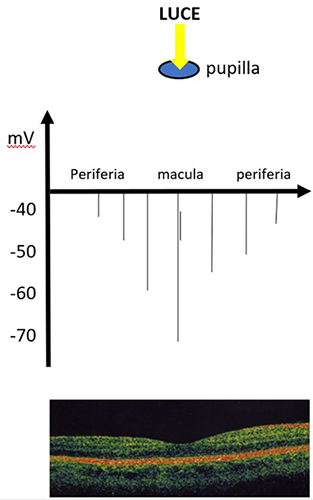
Figura 1. La macula è l’area retinica più illuminata e calda a causa della miosi, dell’accomodazione e della sua morfologia. Nella macula è pertanto favorita la iperpolarizzazione dei fotorecettori che rilasciano poco glutammato. Al contrario, in periferia i fotorecettori saranno meno iperpolarizzati (o più depolarizzati) e rilasceranno una maggior quantità di neurotrasmettitore. Quindi, fisiologicamente nella regione maculare troveremo poco glutammato nello spazio extracellulare.
L’eccitotossicità
Il glutammato è il principale neurotrasmettitore eccitatorio del SNC e della retina, regola lo sviluppo neuronale, la plasticità sinaptica, i processi emozionali e cognitivi, ma quando la sua concentrazione extracellulare aumenta può diventare tossico (eccitotossicità), aumentando lo stress ossidativo, il danno mitocondriale e la produzione di radicali liberi fino a indurre apoptosi. L’eccitotossicità è un processo coinvolto in numerose patologie neurodegenerative come il morbo di Alzheimer, il morbo di Parkinson, la corea di Huntington, l’epilessia, l’ictus, ma anche l’emicrania, il glaucoma cronico e la DMS. L’evidenza clinica che un fenomeno simile possa avvenire nella retina è descritto in un mio recente articolo in cui la patogenesi di una particolare forma di maculopatia detta “maculopatia da popper” dimostrerebbe, con modalità simili ma in tempi diversi ed in soggetti predisposti, l’origine della DMS (1). Oggigiorno gli esseri umani conducono uno stile di vita che li porta a utilizzare molto la vista per vicino e in condizioni di eccessiva illuminazione, aumentando quindi il rischio di sviluppare la DMS a causa dell’insorgenza di interferenze elettrochimiche che si potrebbero verificare durante il processo di fototrasduzione. Ma non solo.
Il sistema glinfatico
L’attenzione che poniamo quando utilizziamo la vista per vicino, ci costringe ad assumere una postura che limita i movimenti degli occhi e del capo. Dal punto di vista embriologico l’occhio è una estroflessione diencefalica e la retina possiede molte analogie anatomiche col cervello. La retina, così come il cervello, produce molte scorie metaboliche soprattutto nella regione maculare: tuttavia, la retina e il cervello non possiedono vasi linfatici per eliminarle. Nel 2012 Iliff et al. pubblicarono uno studio in cui dimostrarono la presenza nel cervello dei topi, funzionalmente analogo a quello umano, di un sistema paravascolare denominato “glinfatico” che, grazie alla contrazione delle arterie, genera una “pompa cerebrale” e spinge il liquido cerebrospinale negli spazi extracellulari, facilitando l’eliminazione delle scorie (2). Questo sistema, sebbene esista anche durante la veglia, sarebbe più efficiente mentre dormiamo (3,4). Nel 2020, utilizzando complesse tecniche neuroradiologiche, alcuni autori evidenziarono la presenza del sistema glinfatico anche nell’uomo (5). È verosimile, quindi, che possa esistere un tale sistema anche nel nervo ottico e nella retina (6,7). Durante lo stato di veglia, l’umor vitreo si muove all’interno del bulbo oculare grazie ai movimenti del capo, alla contrazione dei muscoli volontari extraoculari e all’accomodazione del cristallino, esercitando una pressione positiva e negativa sulla superficie retinica. Questa “pompa vitreale” contribuirebbe al movimento dei fluidi interstiziali aumentando l’eliminazione delle scorie metaboliche dalla retina e spingendole, attraverso le lacune linfatiche della coroide e della sclera, nei vasi linfatici congiuntivali. Anche in questo caso il meccanismo sarebbe più efficiente mentre dormiamo ed avverrebbe durante la fase REM (8,9).
Ricordo che in natura esiste già un sistema che utilizza una pompa vitreale. Gli uccelli, infatti, possiedono una estroflessione retinocoroideale, chiamata “pettine”, che si aggetta nel vitreo e grazie alle torsioni degli occhi durante i movimenti saccadici, facilita gli scambi di ossigeno e nutrienti con la retina (10). Risulta quindi evidente che la scarsa motilità oculare indotta dall’eccessivo lavoro per vicino, l’inappropriata esposizione luminosa e le alterazioni del sonno, compromettendo la funzione del sistema glinfatico e della pompa vitreale, favorirebbero l’accumulo di scorie nel cervello e nella retina (Fig.2).
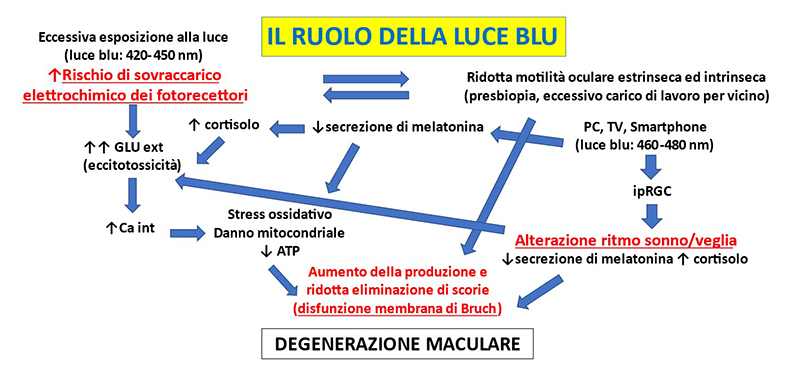
Figura 2. Ruolo della luce blu nella patogenesi della degenerazione maculare.
Conseguenze dell’eccessiva esposizione alla luce blu
Con la diffusione delle sorgenti luminose a LED, la popolazione è soggetta alla costante esposizione alla luce blu anche durante la sera. Mentre l’esposizione alla luce blu è importante al mattino per stimolare il risveglio, la coscienza, l’attenzione, la performance psicofisica, durante le ore serali influenza negativamente i ritmi circadiani e la qualità del sonno (11). Il sonno è un elemento chiave nello sviluppo adolescenziale. Con l’uso eccessivo di strumenti elettronici, il sonno diventa irregolare, accorciato e ritardato in relazione al precoce risveglio per gli impegni scolastici. La concomitante assunzione di alcool e sostanze stimolanti contribuisce al disallineamento tra i ritmi biologici e quelli sociali, impattando negativamente sul sistema nervoso e traducendosi in affaticamento, sonnolenza diurna, deficit di attenzione e di memoria, problemi comportamentali, depressione, ansia e scarso rendimento scolastico (12). Il 50% degli adulti di età superiore ai 60 anni riferisce disturbi della quantità e qualità del sonno. Prove crescenti dimostrano che i disturbi del sonno contribuiscono al declino cognitivo e all’insorgenza della demenza di Alzheimer. Ciò potrebbe sembrare paradossale poiché spesso i disturbi del sonno sono una conseguenza del morbo di Alzheimer. Tuttavia, esisterebbe una relazione bidirezionale, ossia i disturbi del sonno sarebbero una causa precoce che favorirebbe l’accumulo di beta-amiloide e la neuroinfiammazione ma anche una conseguenza tardiva della demenza (13).
Conclusioni
In conclusione, abbiamo visto come la scorretta esposizione alla luce potrebbe creare a livello maculare le condizioni affinché possa verificarsi un cortocircuito elettrochimico che favorirebbe l’insorgenza della DMS e indurre alterazioni dei ritmi circadiani, comportando gravi conseguenze al sistema nervoso. Sono state descritte numerose analogie tra le demenze e le patologie neurodegenerative della retina come la DMS e il glaucoma cronico. L’accumulo di beta amiloide e ferro nelle drusen in corso di DMS, di beta amiloide e proteina tau nelle cellule ganglionari in corso di glaucoma cronico e la conseguente neuroinfiammazione suggeriscono infatti una patogenesi comune al morbo di Alzheimer (14).
Fabrizio Magonio
Responsabile del Servizio di Retina Medica
U.O. di Oculistica
Casa di Cura Igea - Milano
Bibliografia
- Magonio F. “Poppers maculopathy” is an electrochemical overload. Arch clin Exp Ophthalmol. 2022;4(1):1-3.
- Iliff JJ, Wang M, Liao Y et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid. Sci Transl Med 2012; 4: 147, pp 147ra 111.
- Plog BA, Nedergaard M. The Lymphatic System in CNS health and disease: past, present and future. Ann Rev Pathol. 2018; 13:379-394.
- Xie L, Kang H, Xu Q et al. Sleep drives metabolite clearance from the adult brain. Science 2013 Oct 18; 342 (6156):373-7.
- Taoka T et al. Neurofluid dynamics and the glymphatic system: a neuroimaging perspective. Korean J Radiol. 2020 Nov;21(11):1199-1209.
- Wang X, Lou N, Eberhardt A et al. An ocular glymphatic clearance system removes β-amyloid from the rodent eye. Sci Transl Med. 2020 Mar 25;12(536): eaaw3210.
- Sakamoto M, Nakamura K, Shibata M, Yokoyama K, Matsuki M, Ikeda T. Magnetic resonance imaging findings of Terson’s Syndrome suggesting a possible vitreous hemorrhage mechanism. Jpn J Ophthalmol. 2010; 54: 135-139.
- Magonio F. REM phase: an ingenious mechanism to enhance clearance of metabolic waste from the retina. Exp Eye Res. 2022 Jan;214: 108860
- Silva AF, Pimenta F, Alves MA, Oliveira MSN. Flow dynamics of vitreous humor during saccadic eye movements. J Mech Behav Biomed Mater. 2020 Oct; 110:103860.
- Pettigrew JD, Wallman J, Wildsoet CF. Saccadic oscillations facilitate ocular perfusion from the avian pecten. Nature. 1990 Jan 25;343(6256):362-3.
- Wahl S, Engelhardt, Schaupp P, Lappe C, Ivanov IV. The inner clock-blu light sets the human rhythm. J Biophotonics. 2019 Dec;12(12): e201900102.
- Ohayon MM, Carskadon MA, Guilleminault C, Vitiello MV. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep value across the human lifespan. Sleep.2004;27(7):1255-1273.
- Irwin MR. Inplications of sleep disturbance and inflammation for Alzheimer’s disease dementia. Lancet Neurol. 2019 mar;18(3):296-306.
- Wang L, Mao X. Role of retinal amyloid-β in neurodegenerative diseases: overlapping mechanisms and emerging clinical applications. Int J Mol Sci. 2021 Feb 26;22(5):2360.








