L. Morandi
L’insufficienza renale cronica è una condizione sempre più diffusa nella popolazione mondiale. Presentiamo qui il secondo di una serie di tre articoli sull’argomento, che affronta le problematiche nutrizionali della patologia.
Parte della terapia conservativa dell’insufficienza renale Cronica (IRC) si basa sulla somministrazione di una terapia nutrizionale. Il Position Statement della Società Italiana di Nefrologia (SIN) del 20171 sostiene che la terapia nutrizionale ipoproteica è uno dei campi di ricerca nefrologici più interessanti, nonostante permangano alcune perplessità su: composizione dietetica a ogni stadio, tempo di inizio della terapia stessa e gestione delle comorbilità, in particolare nei pazienti più fragili (anziani, diabetici, con sindrome nefrosica).
Evidenze importanti da una review
L’importanza del trattamento nutrizionale dell’IRC viene affrontata in una review2 di Fouque del 2017. In questa pubblicazione vengono analizzati i meccanismi patofisiologici alla base del trattamento dieto-terapico dell’insufficienza renale cronica. Evidenze sperimentali hanno constatato come l’assunzione giornaliera di più di 1,5g/kg p.c./die di proteine possa causare iperfiltrazione glomerulare nonché peggiorare la proteinuria diabetica e ipertensiva. In modelli sperimentali animali, un alto apporto proteico ha portato a una dilatazione delle arteriole afferenti, andando ad aumentare la filtrazione glomerulare. Nel tempo l’iperfiltrazione glomerulare sviluppa un danno al glomerulo stesso. Al contrario, un basso intake proteico giornaliero ha indotto una costrizione delle arteriole afferenti, andando a diminuire la pressione intraglomerulare e, quindi, il lavoro del glomerulo stesso. Questi riscontri hanno evidenziato come una dieta a ridotto contenuto proteico può influenzare positivamente gli effetti dei modulatori dell’angiotensina.
La restrizione proteica ha quindi un effetto protettivo nei confronti del glomerulo, oltre a portare una riduzione della proteinuria. Non solo, diminuire l’intake proteico porta anche a una diminuzione della produzione di urea. Il target terapeutico stimato dalla review consiste nell’assunzione giornaliera di 0.6-0.8g/kg p.c. di proteine al giorno. A questa analisi sull’intake proteico si aggiunge una posizione netta sul sale alimentare.
L’apporto di sodio
Il target terapeutico di sodio giornaliero non è facilmente raggiungibile nei pazienti3 trattati, poiché l’80% del sodio introdotto proviene da fonti non discrezionali. Si stima che gli apporti medi, secondo i dati raccolti dal progetto Minisal-GIRCSI4, della popolazione italiana siano di circa 10,6 g/die di sale. In questo contesto ambientale anche modeste riduzioni del sale, rispetto all’intake medio giornaliero, sembrano apportare un beneficio al paziente5. Per questo motivo la SIN ha incluso nel percorso terapeutico alcune raccomandazioni nutrizionali6. Per prima cosa viene raccomandato di fornire consigli dietetici ai pazienti con IRC, fin dai primi stadi, per quanto concerne l’assunzione di sale e, in base al profilo clinico-biochimico individuale, sull’assunzione di potassio, fosfati, proteine e calorie. Viene raccomandato al curante di porre attenzione a ogni visita sugli apporti di sodio alimentare.
Obiettivo: un intervento nutrizionale corretto
Un eventuale intervento nutrizionale dovrebbe essere associato a una adeguata informazione e formazione, a una visita e a una supervisione dietologica accurate al fine di prevenire uno stato di malnutrizione.
Il cardine della terapia nutrizionale, come esplicitato anche dalle linee guida NFK- KDOQI7, è quello di somministrare un apporto proteico ristretto per diminuire il fosforo e i prodotti di scarto circolanti. A questo si aggiunge la diminuzione del sodio alimentare e la riduzione dell’intake di potassio.
Le diete ipotizzate sono diverse in base al differente grado di IRC e all’età del paziente, come evidenziato nella review di Piccoli et al del 20158. Questa analisi ha evidenziato come la terapia nutrizionale sia da valutare in base all’età dell’individuo, alle sue abitudini alimentari e al grado di IRC prevedendo, per esempio, una dieta vegana nei pazienti giovani, nei lavoratori e in quelle persone che viaggiano spesso. Questo perché una dieta vegana permette una notevole scelta di pasti senza andare a integrare con prodotti appositi e lascia una certa libertà grazie ai pasti liberi concessi.
Nei pazienti anziani invece è preferibile orientarsi verso un diverso trattamento terapeutico, andando a sfruttare abitudini alimentari già strutturate e prodotti aproteici in sostituzione ai prodotti normalmente comprati nel paziente. (Tab. 1). I vantaggi sono legati al poter mantenere le normali abitudini, scegliendo fonti proteiche a elevato valore biologico9.
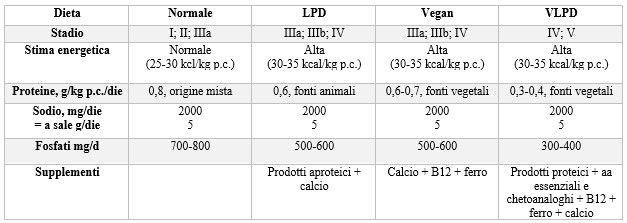
Tabella 1.Schemi terapeutici nutrizionali
Al peggioramento dello stato clinico del paziente la dieta deve essere ulteriormente modificata in una dieta a bassissimo apporto proteico (0,3 g/kg p.c./die) tramite prodotti aproteici e dieta vegana.
A causa dei rischi di malnutrizione nei pazienti che seguono delle terapie nutrizionali a basso apporto di proteine, alcuni studi, come quello di Ikizler
10 et al, hanno evidenziato come sia fondamentale un apporto calorico adeguato di:
- 35 kcal/kg p.c./die per pazienti <65 aa
- 30 kcal/kg p.c./die per pazienti >65 aa
raccomandato anche in caso di sovrappeso/obesità, per prevenire il catabolismo proteico, mantenere un bilancio azotato positivo e mantenere uno stato nutrizionale adeguato.
Per i sedentari è prevista una riduzione del fabbisogno energetico dell’8-14% nelle donne e 16-20% negli uomini.
Bibliografia
- Bellizzi V, Cote G, Borrelli S, Cupisti A, De Nicola L, DI Iorio BR, Cabiddu G, Mandreoli M, Paoletti E, Piccoli GB, Quintiliani G, Ravera M, Santoro D, Torraca S, Minutolo R. Controversial issues in CKD clinical practice: position statement of the CKD-treatment working group of the Italian Society of Nephrology. J Nephrol (2017) 30:159–170
- Kalantar-Zadeh K, Fouque D. Nutritional Management of Chronic Kidney Disease. N Engl J Med 2017; 377:1765-76.
- De Nicola L, Minutolo R, Bellizzi V, Zoccali C, Cianciaruso B, Andreucci VE, Fuiano G, Conte G, for the investigators of the TArget Blood Pressure LEvels in Chronic Kidney Study Group (2004) Achievement of target blood pressure levels in chronic kidney disease: a salty question? Am J Kidney Dis 43:782–795
- Cappuccio FP, Ji C, Donfrancesco C, Palmieri L, ippolito R, Vannuzzo D, Giampaoli S, Strazullo P. Geographic and socioeconomic variation of sodium and potassium intake in Italy: results from the Minisal-Gircsi programme. BMJ Open 2015;5:e007467.
- Esnault VLM, Ekhlas A, Delcroix C et al (2005) Diuretic and enhanced sodium restriction in improved antiproteinuric response to RAS blocking agents. J Am Soc Nephrol 16:474–481
- Linee Guida ISS - SIN - Ministero della Salute (27 gennaio 2012)
- Chronic Kidney Disease (2010) Evidence-Based Nutrition Practice Guideline
- Piccoli GB, Vigotti FN, Leone F, Capizzi I, Dadola G, Cabiddu G, Avagnina P. Low-protein diets in CKD: How can we achieve them? Clin Kidney J (2015) 8: 61-70
- Fouque D, Kalantar-Zadeh K, Kopple J et al. A proposed nomenclature and diagnostic criteria for protein-energy wasting in acute and chronic kidney disease. Kidney Int 2008; 73: 391–398.
- Ikizler TA, Cano NJ, Franch H, Fouque D, Himmelfarb J, Kalantar-Zadeh K, Kuhlmann MK, Stenvinkel P, TerWee P, Teta D, Wang AY, Wanner C. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney International (2013) 84, 1096–1107
Luca Morandi
Medico chirurgo, Milano





